关注高考对pH的考查
时间:2016-02-02 19:37 来源:《数理报》 作者:杨董 点击: 次 所属专题: ph计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
水的电离和溶液的pH值是电解质溶液的重点和难点, 同时也是高考化学试题的热点。分析多年的高考化学试题,我们不难发现:特别是溶液pH值这一知识点试题每年考并且常考常新,重现率100%。这类题目能有效地考查考生的判断、推理运算等思维能力,充分体现体现了高考命题的趋势:由知识向能力型的转变。因此,高二的学生在学习这一部分内容时,依据有关溶液pH计算题目类型的特点,有必要认真加以训练。下面对近五年高考对PH的考查分析如下:
一、pH定义的迁移
例1、(2002年全国理综9)有人曾建议用AG表示溶液的酸度(acidity arede),AG的定义为AG=lg[c(H+)/c(OH-)。下列表述正确的是 ( )
A.在25℃时,若溶液呈中性,则pH=7,AG=1
B.在25℃时,若溶液呈酸性,则pH<7,AG<0
C.在25℃时,岩溶液呈碱性,则pH>7,AG>0
D.在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH)
解析:本题考查了对溶液酸碱性的认识,对pH、AG定义的理解和关系式的推导,能反映学生对数运算的数学基础。新旧知识的融合、检测学生应变能力是高考命题的发展趋势。根据溶液中c(H+)与 c (OH-)的相对大小,来决定溶液的酸碱性。又从pH 和 AG 的定义寻找两者的关系式
A.AG=lg[c(H+)/ c (OH-)]=lg1=0
B. 呈酸性 , c(H+)>c (OH-) , AG>lg1=0
C. 呈酸碱性 c(H+)<c (OH-), AG< lg1=0
D.25℃时, pH+pOH= pkw=14
AG =lg[c(H+)-c (OH-)]=- pH +14- pH=14-2pH=2(7-pH)
故正确答案为D
二、pH的计算(重点掌握溶液的稀释或混合计算)
例 2、等体积混合0.1 mol / L盐酸和0.06 mol / L Ba(OH)2溶液后,溶液的pH值等于( )
A. 2.0 B. 12.3 C. 1.7 D. 12.0
解析:强酸与强碱溶液混合,首先判断是否过量。恰好中和时,pH=7;若非完全反应,则以酸碱的相对量为依据计算。酸过量时求混合溶液的[H+],碱过量时求[OH-]和pOH值,然后再求pH值。求[H+]或[OH-]时,若是等体积混合,除以2;若不是等体积混合,则为两体积之和。单位毫升不必化为升,二元酸、碱算[H+]或[OH-]时要乘2。本题是碱过量,以算[OH-],求pOH值为简捷。
[OH-]=![]() =0.01 mol / L
=0.01 mol / L
pOH=2,pH=14-2=12,
故正确答案应选D。
例3、已知甲、乙两种物质的溶液混合后能发生反应。物质甲的式量为m,物质乙的式量为n。甲、乙按质量比m: n反应后所得溶液的pH>7,而按质量比2m: n反应后所得溶液的pH=7,能同时符合这两项要求的甲、乙是( )
A. H2SO4 KOH
B . HNO3 Ba(OH)2
C. HCl NaOH
D. NaOH H2SO4
解析:选项 A 、 C 、D 的三对物质各自按质量比m: n和2m:n发生反应,均不能同时满足题设的两项要求,唯选项 B 的一对物质无论按质量比m: n,还是按质量比2m:n发生反应,均能同时满足题设的两项要求。
故正确答案应选 B 。
三、pH大小的比较
例4、(04年京浙理综)常温时,以下4种溶液pH最小的是 ( )
A.0.01mol·L-1醋酸溶液
B.0.02mol·L-1醋酸与0.02mol·L-1NaOH溶液等体积混合液
C.0.03mol·L-1醋酸与0.01mol·L-1NaOH溶液等体积混合液
D.pH=2的盐酸与pH=12的NaOH溶液等体积混合液
解析:此题考查的是溶液PH大小的比较。考查考生灵活运用溶液的酸碱性和 PH的定义进行判断的能力。 B.恰好反应生成CH3COONa,水解溶液呈碱性。C.相当于0.01mol·L-1 的醋酸与0.005mol·L-1 的CH3COONa的混合液D.恰好反应生成NaCl, 溶液呈中性。故正确答案为A
四、pH的讨论
例5、(2000年高考全国卷)(8分)25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白;
(1)a值可否等于3(填“可”或“否”)_________,其理由是___________________
(2)a值可否等于5(填“可”或“否”)________,其理由是____________________
(3)a的取值范围是_______________________________________。
解析:
(1)若a=3,由a=0.5b可知b=6,由题设 pH=b的是某一元强碱,与题设矛盾,所以应答“否”
(2)若a=5则b=10,[OH-]b= 10-4mol·L?1 ,中和时,应该有 Va [H+]a= Vb [OH-]b
即 Va/ Vb=[OH-]b /[H+]a =10-4 /10-5 =10>1,与题设 Va<Vb 不符,所以也应答“否”
(3)Va/ Vb<1,可得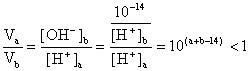 ,又a=0.5b,
,又a=0.5b,
( a+b-14)<0 所以 1.5b<14,即3a<14,a<![]() ,又pH b =b=2a>7[由(1)小题提示强碱溶液的条件],a>
,又pH b =b=2a>7[由(1)小题提示强碱溶液的条件],a>![]() ,因此a的取值范围是所以
,因此a的取值范围是所以![]() <a<
<a<![]() 或4.67>a>3.50
或4.67>a>3.50
正确答案为
(1)否,若a=3,则b=6,溶液显酸性,与题意不符,故a≠3
(2)否,若a=5,[H+]a=10-5mol·L-1,则b=10,[OH-]b= 10-4mol·L-1 ,![]() ,不符合题意,故a≠5 (2分)
,不符合题意,故a≠5 (2分)
(3)
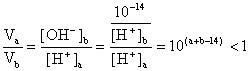
所以(a+b-14)<0,而a=0.5b
即3a<14,a<![]()
又pH=b=3a>7,a>![]()
所以![]() <a<
<a<![]()
五、pH图象的确定
例6、将18.25g2%的盐酸滴入20g2%的NaOH溶液中,下图(图中的横坐标表示滴入试剂的质量)能近似表示这一反应过程的是( )
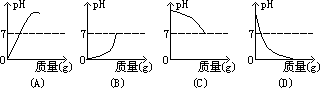
解析:
HCl + NaOH = NaCl + H2O
36.5 40
18.25×2%=0.365 20×2%=0.4
已知未滴入盐酸前NaOH溶液的pH>7,逐滴加入2%盐酸时pH逐渐减小,当向20g2%的NaOH溶液中滴入18.25g2%的盐酸时刚好中和,pH=7。观察以上4个图形知,
正确答案应选(C)。
例7、 在进食过程中和进食后定时地测定唾液的pH发现:进食开始至10分钟,唾液的酸性逐渐增强;10分钟至40分钟,酸性逐渐减弱。符合此事实的图象是( )
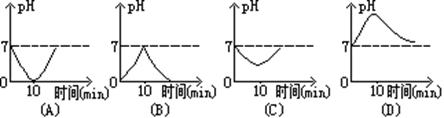
解析:“开始进食至10分钟,唾液酸性逐渐增强”,表明pH逐渐减小。(B)(D)开始是逐渐增大,应舍去。(A)的pH值减小到0,与人体唾液减小到的最低pH值不符,也应舍去。正确答案应选(C)。
六、由PH的大小比较溶液的物质的量浓度
例8、(04年广东)甲酸和乙酸都是弱酸,当它们的浓度均为0.10mol/L时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为a、乙酸、b。由此可知 ( )
A、a的浓度必小于乙酸的浓度
B、a的浓度必大于乙酸的浓度
C、b的浓度必小于乙酸的浓度
D、b的浓度必大于乙酸的浓度
解析:本题通过主要PH的大小考查弱电解质的电离平衡知识和酸的相对强弱等问题。由于C(CH3COOH)=C( HCOOH)=0.10mol/L时,甲酸中的c(H+)等于乙酸中的c(H+)的3倍,故甲酸的酸性强于乙酸的酸性。又因pH(a)>pH(CH3COOH)>pH(b), 即溶液a的 c(H+)<0.10mol/L,CH3COOH的c(H+)<溶液b的c(H+),所以a的浓度小于乙酸的浓度,但无法确定乙酸与b的浓度相对大小(因HCOOH酸性>CH3COOH的酸性)。故正确答案为A

- 全部评论(0)
