浅谈某些氧化还原反应的产物判断
时间:2016-03-27 11:46 来源:上海新川中学 作者:杨董 点击: 次 所属专题: 氧化产物 还原产物 歧化反应 归中反应
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
最近分析研究上海市“东华杯”化学竞赛1996~ 2012年的几份决赛试题第二卷时,发现在试题中有一 类频繁出现的题一一根据题意写出有关化学方程式或 离子方程式。这类问题大部分应用氧化还原反应的原理解决,其中的难点是:变价元素化合价的确定,即变价元素在反应中的产物判断。
变价元素在反应中的产物判断常可分成两类:
一 是歧化反应、归中反应;二是多种变价元素在同一个氧 化还原反应中出现。
1、只有一种元素化合价变化,即歧化和归中
不管是何种反应均要求我们熟悉元素的常见价态, 比如变价较多的氯元素(-1、0、+1、+3、+5、+7)、硫元 素(-2、0、+4、+6)、氮元素(-3、0、+1、+2、+3、+4、+5) 以及碳元素(-4、0、+2、+4)、铁元素(0、+2、+3)等,当 题目中出现非常见价态时,假设该价态成立。
歧化反应产物判断的难点是元素的价态变化和氧化性的强弱判断,而多数原因是后者。
例1、已制得的氯的氧化物有Cl2O、ClO2、Cl2O6、 Cl2O7 等。
(1) 氯气与HgO反应可制得Cl2O,试写出该反应 的化学方程式。
(2) KClO3与浓硫酸可制得ClO2。试写出该反应的化学方程式。
(3) 写出Cl2O6与KOH反应的化学方程式。
分析:第一小题的分析很关键,突破该小题的难点,第二、三小题其意自现。第一小题可能会写出如下两个 反应:Cl2+HgO → Hg+Cl2O; Cl2+2HgO →Hg2O+Cl2O, 从电子得失角度分析,这两个反应似乎都是对的,进一 步思考,当氯气被氧化时,说明遇到了氧化性比它强的 氧化剂,而这两个反应中的氧化剂均为HgO,反问一句, HgO的氧化性强于Cl2吗?显然,这是不能成立的。那么,在这种情况下,氯气只能自己氧化自己,即这是个歧化反应。
这样的例子有很多:水的氧化性强于氯气吗?不可 能,那么氯气和水的反应中,它只能自己氧化自己。二氧化碳的氧化性强于过氧化钠吗?不可能,那么过氧化钠 和二氧化碳的反应中,它只能自己氧化自己。氢氧化钾 的氧化性强于硫吗?不可能,那么硫和氢氧化钾的反应 中,它只能自己氧化自己。这类反应只要比较一下两种 物质氧化性的强弱,难题就会迎刃而解。
第二小题只需从化合价角度分析即可,也是歧化反 应。这样的思想延伸至第三小题,就很容易判断,它也是一个歧化反应。
(1) 2Cl2+HgO → Cl2O+HgCl2
(2) 3KClO3+H2SO4 (浓)→2ClO2+KClO4+K2SO4+H2O
(3) Cl2O6+2KOH → KClO4+KClO3+H2O
例2在Na2S2O3溶液中通入过量的SO2,写出反应的离子方程式。
分析:题中给出了 Na2S2O3和SO2,容易想到是同 种元素不同化合价之间的变化,
看似正确的分析,实则经不起推敲,Na2S2O3中真 有+2价的硫吗?若真有+2价的硫,氧化性会强于+4 价的硫吗?
高中教材中清清楚楚地告诉我们:S2O32-+2H+=S +SO2+H2O,是歧化反应原理;从结构上认识Na2S2O3:
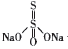
—个硫原子为+6价,另一个硫原子 为-2价,是归中反应原理。无论从哪个角度分析,都清 楚地表明,该反应中的化合价变化,跟加人的硫酸或者是亚硫酸是没有关系的,SO2不过是为反应提供一 个酸性环境,过量的SO2会继续和Na2SO3反应生成 NaHSO3,因此,S2O32-+SO2+H2O →S +2HSO3-
例3已知亚硝酸不稳定。写出NF3与水充分反应 的化学方程式。
分析:初看此题不是氧化还原反应,实则“亚硝酸 不稳定”隐藏了一个歧化反应:HNO2 N为+3价,歧 化反应至它的相邻稳定价态+2和+5,3HNO2→ 2NO +HNO3+H2O ①
凡是有水参加的非氧化还原反应不是化合反应就 是水解反应。“水解”,顾名思义,就是水的解离一一 把水分子拆开,把水分子拆开的一个主要方式就是水 的电离。NF3看成两部分:N3+和F-,异种电荷互相吸引, 分别结合OH-和H+,
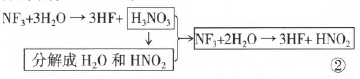
叠加①②式,即可得到最后的反应方程式:3NF3+ 5H2O → 9HF+HNO3+2NO
化学学科中的核心知识:氧化还原反应、异电相 吸、质量守恒定律,在该题中反映得淋漓尽致。
2同一氧化还原反应中,多种变价元素化合价发 生变化
当同一个氧化还原反应中有多种变价元素价态变 化时,产物判断的工具主要是:氧化性、还原性强弱的 比较和“上下楼梯考虑法”即就近原则。
例4、写出碘与氯水反应生成+5价碘的化学方程 式,标出电子转移的方向和数目。
分析:题目中给出的已知条件“生成+5价碘”大大 降低了本题的难度。如果题中没有这一条件的话,解决本题的几个步骤:
(1) 题中的碘元素和氯元素均是具有变价的ⅦA 族元素,碘元素常见价态参考氯元素;
(2) 氯气的氧化性强于碘单质,因此,在此反应中 氯气作氧化剂化合价降低生成HCl;
(3) 碘元素化合价升高,升至何种价态呢?解决这 一问题,回归至氧化还原反应的价态变化。
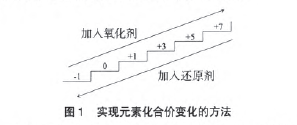
元素在被氧化的过程中,化合价升高一般是就近 原则,即每一次被氧化至它的相邻高价态,就像是在“踏踏实实地,一步一个脚印地爬楼梯”,若相邻高价不能稳定存在,则继续被氧化,化合价继续升高,直到它能稳定存在为止。这一题中,捵单质被氧化到+1价 的HIO,次碘酸不稳定,继续升高到+3价的HIO2,亚碘酸是极不稳定的物质,至今都没有制取到,碘元素化合价继续升高到+5价的HIO3,碘酸能稳定存在,所以, 它的产物是碘酸。
即 I2+5Cl2+6H2O → 2HIO3+10HClO
硫、氮及其化合物的性质可将此就近原则诠释得 相当到位:
例5 (1)硫及其化合物之间的相互转化:
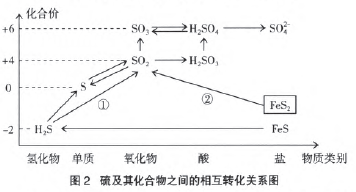
纵观硫及其化合物的相互转化关系,物质之间的 变化主要通过化合价的变化实现。硫元素在被氧化的 过程中,化合价逐步上升至相邻高价;在被还原的过程 中,化合价逐步降低至相邻低价。
例外的是标示数字①和②的两个反应。
①是硫化 氢气体的充分燃烧,看似硫元素的化合价由-2价升高 到了+4价,按照上述原则,硫元素必然经过0价,那它 为什么不在0价停留?氧气充足,硫单质继续被氧化, +4价的产物S02才能稳定存在。
②是工业制硫酸的第一步反应,假设FeS2中的硫 元素为-1价成立,按照上述原则,锻烧硫铁矿的产物 是单质硫,空气充足,单质硫继续被氧化,直至变为稳 定存在的SO2。那在氧气充足的情况下为什么就没有被 氧化为+6价而生成SO3呢?这与反应条件、活化分子 的多少有关,SO2转化为SO3必须要有催化剂的参与。
(2)氮及其化合物之间的相互转化:
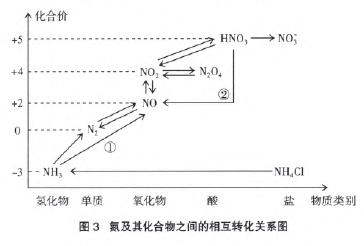
所选物质均为氮元素常见价态代表物。在氮元素被氧化的过程中,基本遵循升高至相邻价态的原则。标示数字①的反应出现了化合价的跳跃,为什么?氨气是由氮气制得的,再由氨气去制取氮气,有意义吗?用催化剂使氮元素继续被氧化。
与此相似,当氮元素在被还原的过程中,同样降到它的相邻价态。标示数字②的反应出现了化合价的跳 跃。为什么稀硝酸和铜的反应中生成的是NO而不是 NO2 ?可以理解为:硝酸越稀,水越多,NO2和水反应了。 当然,在有硝酸参加的反应中,还要考虑硝酸的浓度对 其氧化性强弱的影响,硝酸的浓度越小,氧化性越弱, 生成的产物价态越低。
类似的反应有:氯气氧化单质铁,为什么铁元素化 合价不是升高到+2价?氯气的氧化性比三价铁氧化性强,它只能以+3价的产物存在。碳在足量氧气中燃烧, 为什么生成的产物是二氧化碳呢?不难发现,碳先生成 了一氧化碳,而一氧化碳在氧气中还能继续燃烧,所以 它的产物就只能是二氧化碳了。
综上所述,当氧化还原反应中出现了变价元素时, 我们要提取题目中有用的信息,分析其化合价变化的可 能情况,结合氧化性、还原性的强弱,回归氧化还原反应的实质,判断反应产物。

- 全部评论(0)
