高中化学氧化性强弱顺序最全
时间:2021-11-22 07:56 来源:未知 作者:化学自习室 点击:次 所属专题: 氧化性
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
非金属单质氧化性:一般情况下元素非金属性强的对应的单质氧化性强。
例如:非金属性F>Cl>Br>I>S,则氧化性F2>Cl2>Br2>I2>S
1、同周期(横行,从左到右)元素非金属性递增,单质氧化性增强。
2、同主族(竖行,从上到下)元素非金属性递减,单质氧化性递减。
第六主族:(单质氧化性)O2>S>Se>TE;(元素非金属性)O>S>Se>Te
第七主族:(单质氧化性)F2>Cl2>Br2>I2;(元素非金属性)F>Cl>Br>I
另外注意:氧元素的非金属性要稍强于氯元素;但是单质氧化性却相反,氧化性(Cl2>O2)即:氯气比氧气氧化性稍强些;但是臭氧O3要远比Cl2氧化性强。
金属阳离子的氧化性:
金属活动顺序表排在后面的氧化性越强。
(氧化性较强)Ag+>Hg2+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+......(氧化性很弱了)
其中Fe3+的氧化性介于Hg2+和Cu2+之间:Hg2+>Fe3+>Cu2+
化合物的氧化性:(一定要看溶液pH,化合物氧化性强弱与pH关系很大)
一般情况下:
F2>>O3>>KMnO4(H+)>Cl2>K2Cr2O7(H+)>MnO2>HNO3>浓H2SO4>H2O2>O2>Br2>Ag+>Fe3+>I2>Cu2+>H+
比氢离子更弱的氧化剂一般认为没有氧化性!
注意:
上述排序是根据这些物质在一定条件下的排序(标准状态的电极电势)
而条件改变排序也有可能变动。
例如:Cl2与高锰酸钾氧化性比较:在酸性条件下,KMnO4>Cl2;而在碱性条件下则相反。
重铬酸钾也类同!
如:工业上利用锰酸钾K2MnO4和Cl2在KOH碱性条件下反应制备高锰酸钾KMnO4;
而实验室用高锰酸钾与稀盐酸反应制备氯气。
说明酸性条件下(KMnO4>Cl2);而碱性条件下(Cl2>KMnO4)
再如:Ag+的氧化性是比Fe3+强的氧化剂(能够氧化Fe2+);但是无法氧化I-却发生复分解反应而生成AgI沉淀。
而Fe3+虽然氧化性弱于Ag+但能够氧化I-生成I2。
即便Ag+是比I2更强的氧化剂,而客观上AgI较稳定!
银离子>汞离子>三价铁离子>铜离子>氢离子>二价铁离子>锌离子>铝离子>镁离子>钠离子>钙离子>钾离子>铵根离子
氟气>氯气>氧气>溴气>三价铁离子>碘气>单质硫>单质磷
氟原子>氧原子>氯原子>溴原子>碘原子>硫原子>磷原子
说明:氧气比氯气难拆开,所以氧原子>氯原子,而氯气>氧气
最全物质强弱比较总结:
氟气>高铁酸钾(酸性)>铋酸钠(酸性)>臭氧>过硫酸>高溴酸>过氧化氢>=连二次硝酸>高锰酸钾(酸性)>二氧化铅>亚氯酸>次氯酸>=高碘酸>次溴酸>溴酸>=金离子>氯酸>次碘酸>高氯酸>浓硒酸>=二氧化锰>=重铬酸钾>氯气>浓硝酸>碘酸>氧气>=铂离子>浓硫酸>液溴>氯金酸>二氧化氮>亚硝酸>稀硝酸>汞离子>次氯酸钠(碱性)>银离子>亚汞离子>三价铁>高铁酸钾(碱性)>高锰酸钾(碱性)>锰酸钾(碱性)>铋酸钠(碱性)>碘>一价铜>二氧化硫>二价铜>稀硫酸>非氧化性酸>铅离子>锡离子>亚铁离子>硫单质>锌离子>铝离子>二氧化碳>二氧化硅(四氟化硅)>一氧化碳>氢气>偏铝酸根>镁离子>钠离子>钙离子>钡离子>钾离子
高中阶段常见物质氧化性强弱顺序:
F2>MnO4->Cl2>HNO3>H2SO4(浓)>Br2>Fe3+>Cu2+>I2>S>P>C>Si>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
1,MnO4-氧化性 酸性>中性>碱性
2,KMnO4>MnO2>O2,
3,HClO>HClO2>HClO3>HClO4(这和酸性是相反的,经常在这挖坑)
4 、O3>O2
5、氧化剂浓度越大,温度高,氧化性提高。
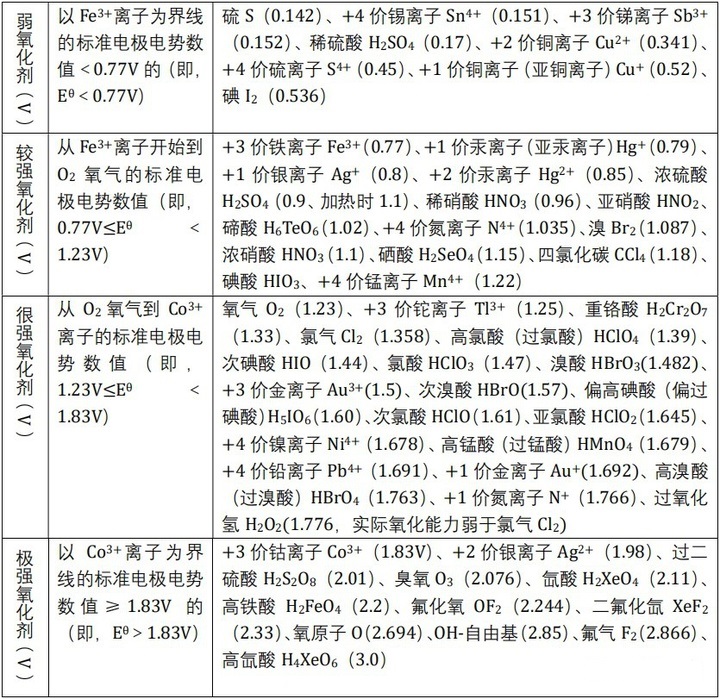
定量氧化性的比较
标准电极电势代数值越大,表明电对的氧化态越易得到电子,即氧化态就是越强的氧化剂。依据Eθ代数值的大小,将氧化剂的氧化性由弱到强归纳如下:

- 全部评论(0)
(1703862265) 评论 高中化学氧化性强弱顺序最:臭氧氧化性远大于氯气
(1549267815) 评论 高中化学氧化性强弱顺序最:氯气氧化性比臭氧弱的吗?
(4890675643) 评论 高中化学氧化性强弱顺序最:二价铜离子的氧化性不是比碘的强吗?
(14749309521) 评论 高中化学氧化性强弱顺序最:总结的真不错,继续
