氧化还原反应规律释疑
时间:2021-11-09 09:39 来源:未知 作者:王笃年 点击: 次 所属专题: 氧化还原反应规律
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氧化还原反应是一类重要的化学反应,其中蕴涵 着“对立统一”等哲学思想.氧化还原反应中有一些重 要的规律,有的比较容易理解,如“有氧化必有还原”、 “氧化剂得电子总数等于还原剂失电子总数"等,而有 的规律如果不加深入思考则较难理解.
1、如何理解“在自发的氧化还原反应中,总是氧 化剂的氧化性大于氧化产物的氧化性、还原剂的还原性大于还原产物的还原性”?
根据氧化还原反应的有关概念可知,氧化还原反 应可用如下简化模型表示:

也就是说,还原剂失去电子后变为氧化产物,而氧化剂得到电子后则变为还原产物,反过来也可以这么想,还原剂就是携带有电子的氧化产物;而还原产 物则是携带有电子的氧化剂,这样一来,自发的氧化还原反应就可看作是氧化剂跟氧化产物争夺电子的过程,结果如何呢?反应向右进行了,氧化产物“乖乖 地''把自己携带的电子“交给”了氧化剂,说明氧化剂的夺电子能力的确比氧化产物要强,同理可理解还原剂的还原性比还原产物强。
2、如何理解同种元素原子间发生氧化还原时的 “化合价不交叉规则”?
在学习中学生会遇到过这样的问题:“在反应 KClO3+6HCl= KCl + 3H2O + 3Cl2↑ 中,每得到 3 mol Cl2,转移了几摩尔电子?”,答案是5 mol 而不是6 mol,即产物KCl中的氯元素不是来自KClO3而是来自盐酸一同种元素原子间发生氧化还原时,要遵守 '‘化合价不交叉规则”。
什么叫化合价不交叉?为什么化合价不能交叉? 让我们以上述反应为例做一分析:根据氧化还原反应中电子“有得必有失”的原则可知,上述反应中,HCl 中一1价的氯被氧化,而KClO3中+ 5价的氯被还原。现在我们假设+5价氯是一步步被还原的,它所得的每个电子都来自HCl,而HCl中的一1价氯失去1个 电子则变为0价(Cl2中的氯原子),当+ 5价的氯连续得5个电子后,它本身也变为了0价(Cl2中的氯),这 时该0价的氯原子还会不会继续获得1个电子变为 —1价(KCl中的氯)呢?肯定是不会的,因为下列电 子转移的结果与转移前是完全一样的一一都是1个 -1价氯原子和1个0价氯原子,没有意义。
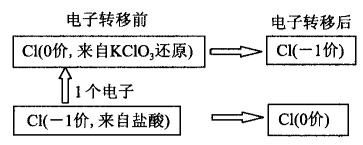
所以上述假设并不成立,KClO3中+ 5价的氯只 被还原到0价就不会再被还原,也就是说反应过程中不会有下列化合价交叉的现象发生:
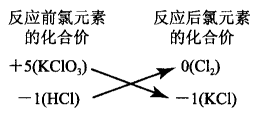
需要提醒大家注意的是,氧化还原反应学习过程中,有些看似合理的“伪规律",如“元素的化合价越高,对应化合物的氧化性越强”,下边我们对其做一 剖析。
首先,不同元素之间是无法根据化合价高低判断氧化性强弱的,如+ 1价的Ag+具有非常强的氧化 性,而+ 5价的磷元素氧化性却并不突出.
其次,同种元素也不是化合价越高氧化性越强. 比如,HClO与HClO4相比,前者氯元素只是+ 1价 而后者氯元素是+ 7价,但前者的氧化性极强而后者则氧化性不太强,再比如,SO2中硫元素为+ 4价,它 可以氧化H2S气体,而稀硫酸中硫元素为+ 6价,却不能氧化H2S。
我们说,化合价高只是提供了物质具备氧化性的 一个条件,它是否能显示出氧化性,还要看该价态的物质在反应条件下是否稳定,就像我们知道的一样, 鸡蛋很脆弱,但经过严密包装后,也可以做到从高楼 上扔下而保持完好,HClO氧化性比HClO4强就是这个原因。
再如,同样是H2SO4,浓硫酸具有强氧化性而稀硫酸则氧化性很弱,主要是由于稀硫酸中硫酸分子发 生了电离,硫元素主要以具有正四面体结构的SO42-(水合离子)形式存在,与硫酸分子相比,该结构相当稳定、不易被破坏。

- 全部评论(0)
