离子极化对化学键的影响
时间:2022-04-06 10:24 来源:未知 作者:化学自习室 点击:次 所属专题: 离子极化 化学键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
离子极化是美国无机化学家法扬斯,K.KasimirFajans (1887~1975) 于 1913 年提出的,常用于解释金属化合物的性质。
顾名思义,离子极化是由于离子之间相互作用产生的,那么必然是由离子构成的化合物才能发生离子极化。由离子构成的化合物首先应该是离子化合物。所以,离子极化要解释和推测的是广义的离子化合物(极化后就不一定是离子化合物了)。
离子化合物是相邻但不相交的正负离子之间以离子键(静电引力)结合的,正离子的电子完全转移给了负离子,没有外界干扰的情况下,正负离子可以看做刚性小球。
但是正负离子分别为对方提供了一个小型电场,而且微粒本身一直在不停地运动着,“没有外界干扰的情况” 是不存在的,
离子极化的结果
当极化能力强的正离子和变形性大的负离子接近时,发生极化现象:负离子的电子云发生变形,结果负离子的电子被拉向两核之间,使两核间的电子云密度增大。
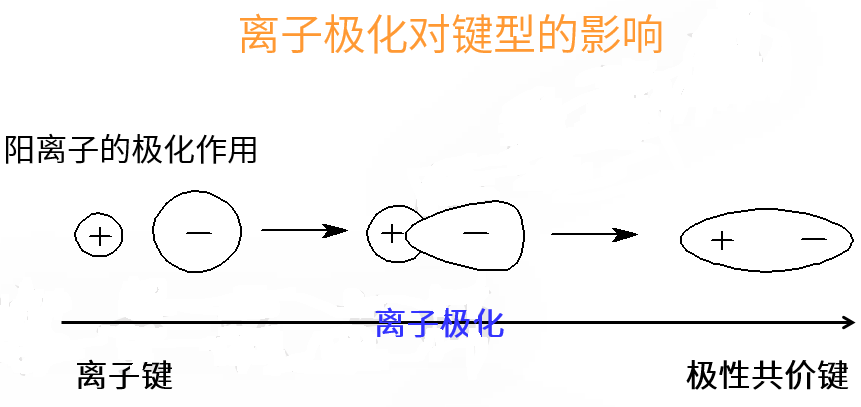
于是,原来相邻的正负离子之间出现了电子云的交叠——电子云重叠是共价键的形成本质,因此离子极化使离子键向共价键过渡。
其实,绝对不发生离子极化的离子化合物是不存在的,也就是说没有绝对的离子键,离子键中总会有共价(电子云重叠)成分的存在,或多或少而已。
离子极化程度最小的当属电荷低、半径大的8e构型阳离子Cs+ 和阴离子F- 了,它们的极化能力和变形性都很小,而且它们也是元素周期表除放射性元素之外电负性差值最大的成键双方。成键双方电负性相差越大,越容易得失电子形成离子键,所以,CsF 是极化作用最小的离子键。
但是根据计算,CsF中化学键的离子性百分数仅为 92%,也就是说有 8% 的共价键的成分存在。
因此我们可以说离子键是一种特殊的共价键,一种极性最强的共价键。
我们通常所说的离子键是指单键中离子性成分大于 50%,如果小于 50% 则看做共价键。
根据成键双方的电负性差值可以估算键的极性,一般来说,
△X > 1.7,发生电子转移, 形成离子键;
△X = 1.7,单键有50%离子性;
△X < 1.7,不发生电子转移, 形成共价键。
既然化学键的性质变了,极性减小了,物质的微观和宏观性质也会随之改变。
最典型的,莫过于溶解度了吧,
“相似相溶”,离子键向共价键过渡,极性减小,在极性溶剂水中的溶解度减小。

- 全部评论(0)

