难溶电解质的3个教学误区
时间:2022-07-21 10:06 来源:化学教育期刊 作者:陈彬城 点击:次 所属专题: 溶解平衡
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、问题的提出
难溶电解质是近几年高考选择题的考查热点,主要考查溶度积Ksp的大小、溶解度的大小以及沉淀转化3者的因果关系。教学实践中,有不少人由于对这3者的关系分析不到位而出现错误的判断,以下就教学实践中易出现的3个误区进行探讨。
二、Ksp与溶解度的关系
1. 常见的教学误区
难溶电解质的Ksp越大,其溶解度越大,或难溶电解质的溶解度越大,其Ksp越大。
2. 问题探讨

从公式④可看出,影响溶解度大小的因素除了Ksp,还有溶质的摩尔质量M和化合物的组成类型即a、b的值。
已知Ksp则可以通过公式④计算溶解度,如已知:Ksp (AgCl)=1.8×10-10,则S(AgCl)=0.1×1435×(1.8×10-10)1/2g=1.93×10-4g
公式④是Ksp与溶解度最简单的换算关系,若要更准确地计算溶解度,必须同时考虑溶液中离子强度的影响以及其他平衡体系(如离子对、水解平衡、络合平衡等)的存在[1]。实践表明,通过Ksp来计算溶解度,不管考虑多少种因素的影响,计算值与实验测得的实际溶解度都有一定的差异。
在高中阶段的教学中,不少人对Ksp与溶解度换算关系的理解,仅停留在公式④上,甚至更浮浅,然后就草草下结论:Ksp越大,溶解度越大。旨在通过数据论证这一观点的错误,故选用公式④来计算表1中几种物质的溶解度。虽然计算值与真实溶解度有一定的差异,但其大小与真实值具有同步性。
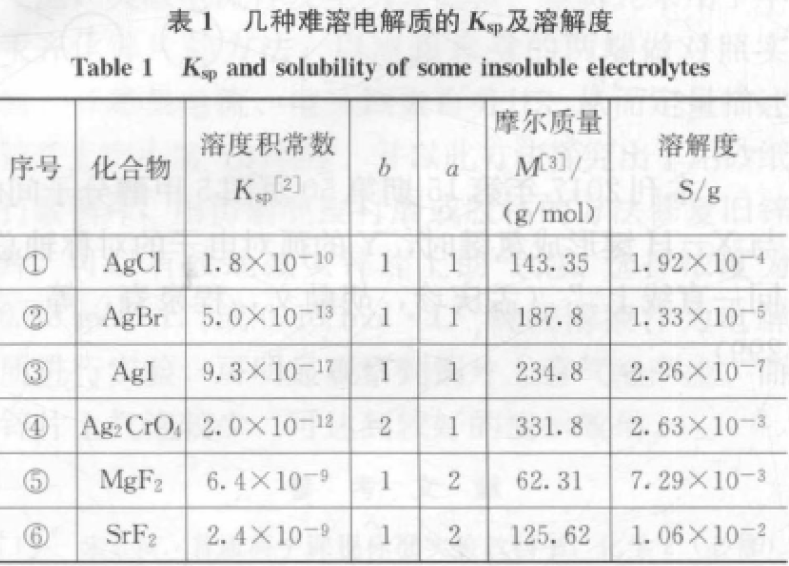
从①②③可知,组成类型相同的难溶物,如果Ksp相差较大,则Ksp越小,溶解度越小。
从⑤⑥可知,组成类型相同的难溶物,如果Ksp相差较小,而摩尔质量相差较大;则溶解度的大小不由Ksp决定,而由其摩尔质量决定。
比较①与④可知,组成类型不同的物质,其溶解度的大小不能由Ksp的大小来判断。
由此可知Ksp的大小不能直接决定溶解度的大小。
3 .结论
Ksp的大小能在一定程度上反映该物质溶解度的大小,如Ksp很小的物质,其溶解度也很小,但不能认为Ksp越小溶解度就越小,即Ksp不能直接用于溶解度大小的比较,特别是组成类型不同的物质,如AgCl的Ksp比Ag2CrO4大,但其溶解度却比Ag2CrO4小。对于组成类型相同的物质,如果Ksp相差较大,如AgCl、AgBr、AgI,则Ksp小的物质溶解度小。
若用难溶物的饱和溶液的物质的量浓度c来表示溶解度,则组成类型相同的物质,Ksp和c的大小关系保持一致[4]。
三、沉淀转化与溶解度大小的关系
1 .常见的教学误区
溶解度大的沉淀能转化为溶解度小的沉淀,溶解度小的沉淀不能转化为溶解度大的沉淀,或者认为沉淀A能转化为B,则说明B的溶解度小于A。
2 .问题探讨
2.1 沉淀转化的计算
沉淀转化的常见模式为:往A沉淀(或A的浊液)中滴加含C离子的溶液,沉淀A转化为沉淀B。沉淀的转化难易程度可通过C离子浓度的大小进行比较,所需C离子浓度越小,沉淀越容易转化。以下比较AgCl与AgBr相互转化的难易程度:
(1)往AgCl沉淀或浊液中滴加含NaBr的溶液
AgCl浊液中的银离子浓度为:
c(Ag+)=[Ksp(AgCl)]1/2=[ 1.8×10-10]1/2mol/L=1.34×10-5mol/L
析出AgBr沉淀要求:
Qc=c(Ag+)c(Br-)>Ksp (AgBr)
则c(Br-)>Ksp(AgBr)/c(Ag+)=(5.0×10-13)/(1.34×10-5)mol/L=3.7×10-8mol/L
即只要c(Br-)>3.7×10-8mol/ L,可使AgCl转化为AgBr沉淀。
这样的转化可轻易发生,因为要使溶液中的c(Br-)>3.7×10-8mol/ L 是轻而易举的。
(2)往AgBr沉淀或浊液中滴加含NaCl的溶液
AgBr浊液中的银离子浓度为:
c(Ag+)=[Ksp(AgBr) ]1/2=[ 5.0×10-13]1/2mol/L=7.07×10-7mol/L
析出AgCl沉淀要求:
Qc=c(Ag+)c(Cl-)>Ksp(AgCl)
则c(Cl-)>Ksp (AgCl)/c(Ag+)=[(1.8×10-10)/(7.07×10-7)] mol/L=2.5×10-4mol/L
即只要c(Cl-)>2.5×10-4mol/ L,可使AgBr转化为AgCl沉淀。
这样的转化也可轻易发生,因为要使溶液中的c(Cl-)>2.5×10-4mol/L 也是轻而易举的。
由此可知AgCl可转化为AgBr,AgBr也可转化为AgCl;从沉淀转化所需的c(Br-)<c(Cl-)可知AgCl较易转化为AgBr。
表2为按以上方法计算得到的沉淀转化时所需的离子浓度。
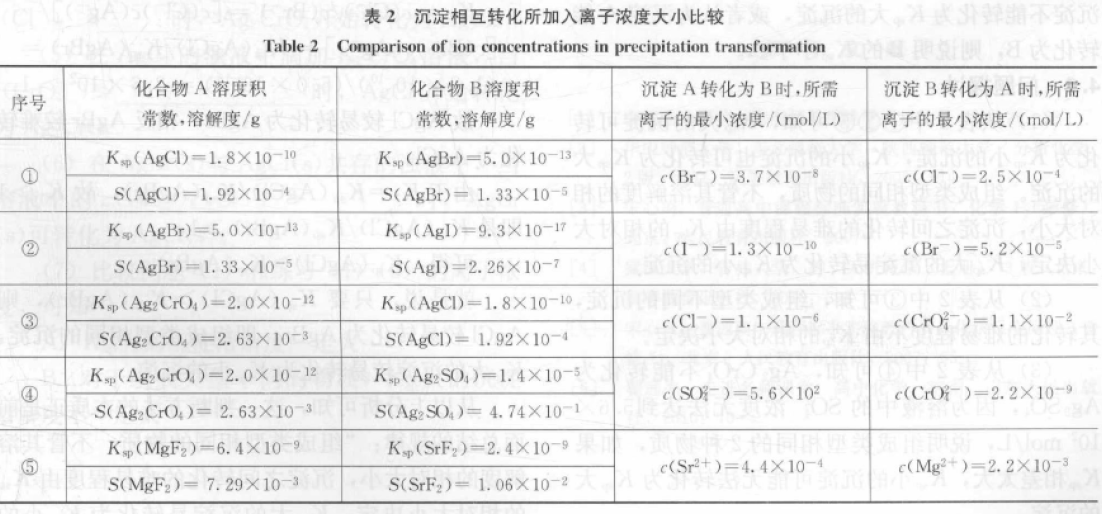
2.2 分析
(1)从①②③可知,溶解度大的沉淀可转化为溶解度小的沉淀,溶解度小的沉淀也可转化为溶解度大的沉淀,相比之下,溶解度大的沉淀较易转化为溶解度小的沉淀。
(2)从⑤可知,溶解度较小的MgF2更易转化为溶解度较大的SrF2,因为组成类型相同的沉淀,不管其溶解度的相对大小,其相互转化的难易程度,由Ksp的相对大小决定。
故(1)的说法虽然符合大多数的沉淀转化,但并不符合所有物质的转化。
(3)从④可知,Ag2CrO4不能转化为Ag2SO4,因为溶液中的SO42-浓度无法达到5.6×102mol/L,说明如果2种物质的溶解度相差太大,溶解度小的沉淀可能无法转化为溶解度大的沉淀。
3 .结论
溶解度大的沉淀可转化为溶解度小的沉淀,溶解度小的沉淀也可转化为溶解度大的沉淀。一般来说,溶解度小的沉淀转化为溶解度大的沉淀容易实现,2者的差别越大,转化越容易。
在实验方案中,若没有说明沉淀转化时各离子的具体浓度,仅仅出现沉淀转化,不能得出关于溶解度相对大小的结论。如“往Mg(OH)2的浊液中加入0.1 mol/L CuSO4溶液,出现蓝色沉淀”,可知“Mg(OH)2能转化为Cu(OH)2”,但不能得出“Cu(OH)2的溶解度更小”的结论。
四、 沉淀转化与Ksp大小的关系
1. 常见的教学误区
Ksp大的沉淀能转化为Ksp小的沉淀,Ksp小的沉淀不能转化为Ksp大的沉淀,或者认为沉淀A能转化为B,则说明B的Ksp小于A。
2.问题探讨
(1)从表2中①②⑤可知,Ksp大的沉淀可转化为Ksp小的沉淀,Ksp小的沉淀也可转化为Ksp大的沉淀。组成类型相同的物质,不管其溶解度的相对大小,沉淀之间转化的难易程度由Ksp的相对大小决定,Ksp大的沉淀易转化为Ksp小的沉淀。
(2)从表2中③可知,组成类型不同的沉淀,其转化的难易程度不由Ksp的相对大小决定。
(3)从表2中④可知,Ag2CrO4不能转化为Ag2CrO4,因为溶液中的SO42-浓度无法达到5.6×102mol/L,说明组成类型相同的2种物质,如果Ksp相差太大,Ksp小的沉淀可能无法转化为Ksp大的沉淀。
3. 结论
Ksp大的沉淀可转化为Ksp小的沉淀,Ksp小的沉淀也可转化为Ksp大的沉淀。组成类型相同的物质,不管其溶解度的相对大小,沉淀之间转化的难易程度由Ksp的相对大小决定,Ksp大的沉淀易转化为Ksp小的沉淀。组成类型不同的沉淀,其转化的难易程度不由Ksp的相对大小决定。
在实验方案中,若没有说明沉淀转化时各离子的具体浓度,仅仅出现沉淀转化,即使物质的组成类型相同,也不能得出关于溶度积相对大小的结论。如“往AgBr的浊液中加入0.1 mol/L NaCl溶液,出现白色沉淀”,可知“AgBr能转化为AgCl”,但不能得出“AgCl的溶度积更小”的结论。
4 .利用平衡常数K判断沉淀转化的难易程度
组成类型相同的沉淀之间的转化,也可以通过平衡常数的大小来判断转化的难易程度。如AgCl与AgBr的相互转化:
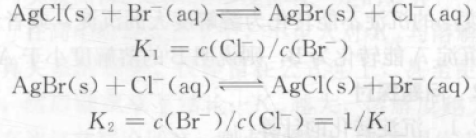
K越大表示沉淀转化越易进行,要证明AgCl更易转化为AgBr,只需:K1>K2
即K1>1/K1可得K1>1,由此可知:
组成类型相同的沉淀之间的转化,若K>1,表示沉淀转化较易进行,且K越大,该转化越易进行;若K<1,表示沉淀转化较难进行,且K越小,该转化越难进行。
K1=c(Cl-)/c(Br-)=[c(Cl-)c(Ag+)]/[c(Br-)c(Ag+)]=Ksp(AgCl)/Ksp(AgBr)=(1.8×10-10)/(5.0×10-13)=3.6×102>1
故AgCl较易转化为AgBr,相反AgBr较难转化为AgCl。
由于K1=Ksp(AgCl)/Ksp(AgBr),故K1>1即是Ksp(AgCl)/Ksp(AgBr)>1,可得:Ksp(AgCl)>Ksp(AgBr)
就是说,只要Ksp(AgCl)>Ksp(AgBr),则AgCl较易转化为AgBr,即组成类型相同的沉淀,Ksp大的沉淀较易转化为Ksp小的沉淀。
从以上分析可知,这一判断方法的本质正是前面总结的规律:“组成类型相同的物质,不管其溶解度的相对大小,沉淀之间转化的难易程度由Ksp的相对大小决定,Ksp大的沉淀易转化为Ksp小的沉淀。”

- 全部评论(0)
