探究硝酸溶解碘化银的条件
时间:2022-11-29 15:04 来源:未知 作者:化学自习室 点击:次 所属专题: 碘化银 硝酸
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在中学化学,检验溶液中是否存在I-,其方法是取 少量试液于试管中,并向其中滴加AgNO3(aq),有黄色 沉淀产生后,再滴加稀HNO3,如果黄色沉淀不溶解,则 证明溶液中存在「。但当我们认识到「具有强还原 性,HNO3具有强氧化性,两者之间易发生氧化还原反应 8H++2NO3-+6I-=3I2+2NO↑+4H2O矛盾就产生 了——在检验I-的实验中滴加的稀HNO3与I-发生反 应,使c(I-)减小,将促使溶解平衡AgI(s) Ag+ (aq) + I-(aq)正向移动,黄色沉淀应该最后消失,而事实上 并非如此。这是哪里出了问题?
Ag+ (aq) + I-(aq)正向移动,黄色沉淀应该最后消失,而事实上 并非如此。这是哪里出了问题?
为了解决这个问题,我们先用标准电极电势,从定 量角度分析硝酸是否可以氧化I-。将氧化还原反应 8H+ +2NO3- +6I-=3I2+2NO↑+4H2O, 拆成两个半反应,并查出它们的标准电极电势。[注:在标准电极电势 中 c(I-)、c(H+)、c(NO3-)均为 1 mol/L,NO 的分压为 1,温度为298 K。
氧化反应:2I--2e- =I2 φ(-)=0.535 V
还原反应:4H++ NO3- +3e-= NO↑ + 2H2O φ(+)=0.96 V
则该条件下,总反应的电动势差:
E =φ( + ) -φ( - ) =0.96 V-0.535 V =0.425 V >0.3 V
根据已知:当E>0时,该反应能自发进行。
当E>0.3 V时,该反应的平衡常数>105,反应趋于完全进行。
计算结果证明,当反应物离子浓度均为1 mol/L 时, 稀硝酸可以氧化I-。
在 298 K 条件下,将 2 mol/L HNO3与 2 mol/L KI 等 体积混合,立即看到橙黄色溶液,滴加CCl4,振荡、静置 后,下层呈紫红色。实验也证明了反应物离子浓度均为 1 mol/L 时,硝酸很容易氧化I-。
接下来我们再分析硝酸是否可以氧化AgL中的I-, 使其溶解。如果各离子浓度不是1 mol/L,则其条件下 的电极电势需用奈斯特方程计算。
已知,当温度为298 K时,奈斯特方程推论公式为中φ =![]() ,n表示电子转移数,则该 反应的φ( + )和φ(-)表示如下:
,n表示电子转移数,则该 反应的φ( + )和φ(-)表示如下:

为研究方便,我们取298 K时AgI悬浊液1 mL,模拟检验I-时生成的AgI,根据、(AgI) = 9. 3 ×10 -17 ,则 该溶液中的 c(I)≈9.6×10-9mol/L
仅当反应的电势差E>0时,硝酸才能氧化I-,使 AgI溶解。
即 E =(P( + ) -(P( - ) >0
再将(1)(2)式代入上式后,得:
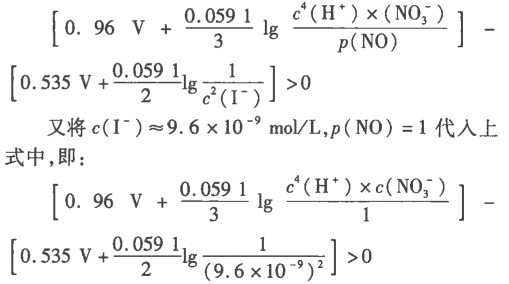
又将 c(I-)≈9. 6 ×10-9mol/L,P( NO) =1 代入上

解得:c(HNO3)>3. 14 mol/L
计算结果说明,混合液中的硝酸浓度高于3.14 mol/L 时,AgL才会被硝酸溶解。
我们再用实验论证,在298 K时,将KI(aq)和 AgNO3(aq)混合,制得AgL悬浊液,再用离心机分离得到 AgL固体,将其洗涤后置于水中得到AgL悬浊液。取 1 mL 该悬浊液,向其中加入ImL 6. 28 mol/L 硝酸、 0.5 mL CCl4,振荡、静置,下层无明显变化。再向溶液中 逐滴滴加浓硝酸,并不断振荡、静置,可以观察到下层从 无色逐渐变为淡红色,且颜色不断加深。实验证明了低 浓度硝酸不易溶解AgL,硝酸浓度越大,AgL越易被溶解。
需要说明的是,以上计算数据和实验结果均用的是 AgL饱和溶液(温度298 K)。在检验I-实验的实际操作 中,若混合液中c(I-)越小,溶解AgI所需要的硝酸浓度 就越高。因此,为了观察到黄色沉淀不溶于硝酸,一般 需加入稍过量的AgN03以降低c(R),或选用浓度低于 3.14 mol/L 的硝酸。

- 全部评论(0)
