高考物质的量浓度题型和解题策略
时间:2016-01-17 12:21 来源: 作者:董啸 点击: 次 所属专题: 物质的量浓度计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
解题策略:根据定义c=n/V,代入有关量求解或由选项特点巧解。注意:①有的气体与水反应,溶质不是原气体了;②由密度求体积时,一般单位为mL,要除以1000转换为L。
例1 (MCES98)标准状况下,aLHCl溶于1000g水中,得到的盐酸密度为bg/mL,则该盐酸浓度是
A.a/22.4mol/L B.ab/22400mol/L
C.ab/(22400+36.5)mol/L D.1000ab/(22400+36.5a)mol/L
解析:法一 由定义
c= 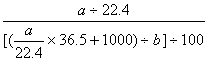 =1000ab/(22400+36.5a)
=1000ab/(22400+36.5a)
法二 a单位L,b单位g/mL,两者单位统一a乘以1000。选D。
二、根据溶解度求物质的量浓度
解题策略:取100g溶剂,则溶质的质量为溶解度,由此求溶质的n和溶液V,由定义求:c=n/V。
例2 (MCE93)相对分子质量为M的某物质在室温下的溶解度为Sg,其饱和溶液密度为ρg/cm3,则物质的量浓度为
A.M/10S ρmol/L B.1000Sρ/M(100+S) mol/L
C.10Sρ/M mol/L D.M(100+S)/1000Sρ mol/L
解析:法一 定义法C=(S/M)÷[(100+S)/ρ×10-3]
法二 n=S/M 求V用100+S且在分母,由选项知选B.
三、根据溶液的质量分数求物质的量浓度
解题策略:抓住两者的换算公式:c=(1000×ρ×ω)/M
例3 (MCE89)体积为VmL,密度为dg/cm3的溶液,含有式量为M的溶质mg,其浓度为Cmol/L,质量分数为w%,下列表示式中正确的是
A.c=(w×100×d)/M B.m=V×d×![]()
C.w%=(c×M)/(1000×d)% D.c=![]()
解析:对A应为:c=(w%×1000×d)/M=(w×10×d)/M;对B溶质的质量为:m(溶质)=m(溶液)×ρ=(v×d)×w%;对C取1L溶液溶质的质量分数为:w%=[(c×M)/1000×d]×100%=[(c×M)/10×d]%;对D: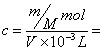
![]() mol/L。因此答案为B、D。
mol/L。因此答案为B、D。
四、由离子浓度求另一离子量浓度
解题策略:由电荷守恒原理求解,注意不是一价离子的,其浓度要乘以其化合价的数值。
例3 (MCE90)若20g密度为dg/cm3的硝酸钙溶液里含1g Ca2+,则NO3-离子的浓度是
A.d/400mol/L B.20/dmol/L C.2.5dmol/L D.1.25mol/L
解析:由溶液中阴阳离子所带电荷总数相等得:[Ca2+]×2=[ NO3-]×1
![]() c=2.5d mol/L。选C。
c=2.5d mol/L。选C。
五、求稀释后溶液的物质的量浓度
解题策略:根据稀释前后溶质的质量或物质的量不变求解:m1ω1=m2ω2、c1V1=c2V2。
例5 (CME92)某温度下22%NaNO3溶液150mL,加100g水稀释后浓度变为14%,求原溶液的物质的量浓度。
解析:设原溶液的质量为x
根据稀释前后溶液溶质守恒,有:22%x=14%(x+100g) x=175g
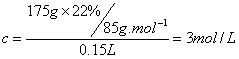
六、求混合溶液中离子的物质的量浓度
解题策略:根据c=n/V,求出离子的n和溶液的V即可。
例6 (MCE94)100mL0.3mol/LNa2SO4溶液和50mL0·2mol/L aL2(SO4)3溶液混合后,溶液中SO42-离子的物质的量浓度为
A.0.20mol/L B.0.50mol/L C.0.40mol/L D.0.25mol/L
解析:[SO42-]=n(SO42-)/V
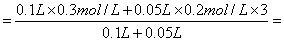 0.4mol/L。选C。
0.4mol/L。选C。
七、求物质参加反应前的物质的量浓度
解题策略:根据化学方程式求出物质的n,由c=n/V解题。
例7 (02年苏豫大综合)在100mL含等物质的量的HBr和H2SO3的溶液里通入0.01molCl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于
A.0.0075 mol/L B.0.008 mol/L C.0.075 mol/L D.0.08 mol/L
解析:设HBr和H2SO3的物质的量为x
由题意H2SO3的还原性强于Br-,因此当Br-被氧化时,H2SO3已全部参加反应了。
H2SO3+Cl2+H2O=2HCl+H2SO4 2HBr+Cl2=Br2+2HCl
x x x/2 x/4
x+x/4 =0.01mol x=0.008mol [HBr]=[H2SO3]=0.008mol/0.1L=0.08mol/L。答案为D。
【逆向思维练习】
1.(MCE98)300mL某浓度的NaOH溶液中含有60g溶质。现要配制1mol/LNaOH溶液,应取原溶液与蒸馏水的体积比约为
A.1:4 B.1:5 C.2:1 D.2:3
2.(MCES98)100g浓度为18mol/L密度为ρg/mL的浓硫酸中加入一定的水稀释成9mol/L的硫酸,则加入水的体积为
A.小于100mL B.等于100mL C.大于100mL D.等于100/ρmL
3.(MCE01.17)向100mL0.10mol.L-1的AgNO3溶液中加入100mL 溶有2.08g BaCl2的溶液,再加入100mL 溶有0.010mol CuSO4·5H2O的溶液,充分反应。下列说法中正确的是
A.最终得到白色沉淀和无色溶液
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物
C.在最终得到的溶液中Cl-的物质的量为0.02mol
D.在最终得到的溶液中Cu2+的物质的量溶液为0.01mol.L-1
4.(MCE01.25)标准状况下,用一定量的水吸收氨气后制得浓度为12.0mol/L,密度为0.915g/cm-3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。
(本题中氨的式量以17.0计,水的密度以1.00 g/cm-3计)
答案:1.A 2.A 3.B 4.1体积水吸收378体积NH3气(标准状况)

- 全部评论(0)
评论 href="/plus/view.php?aid=3394">高考物质的量浓度题:HENHAO
