谈谈氢键
时间:2014-01-17 14:36 来源:未知 作者:王利平 点击: 次 所属专题: 氢键02
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
我们知道,结构相似的同系列物质的熔、沸点一般随着其分子量的增大而升高,按此推测,HF、H2O、NH3的沸点应比HCl、H2S、PH3更低,但实际上却高得多,这种反常现象说明了HF、H2O、NH3分子之间存在较大的作用力,人们把这种作用力称为“氢键”。
一、氢键的形成及特点
下面以水分子为例来说明氢键的形成,有水分子中,H和O以共价键结合,由于氧的电负性较大,共用电子对被强烈地引向O原子的一方,而H原子外只有一个电子,被O原子强烈吸引的结果,使它几乎变成"裸露"的氢核,这个半径很小且带正电的"裸核"与另一水分子中O原子的孤电子对相吸引,结果水分子之间就形成氢键而O-H…O缔合在一起。氢键的本质基本上还是静电作用。氢键缔合受温度的制约,温度升高,缔合程度减小,以至于缔合情况消失。
氢只有跟电负性大且原子具有孤电子对的元素化合后,才能形成较强的氢键。氢键能存在于晶体、液体甚至于气体中。能形成氢键的物质很广泛,如水、醇、胺、羧酸、无机酸、水合物、氨合物及对生命有重要意义的物质蛋白质、脂肪、糖等。
氢键的键能一般在41.84KJ/mol以下,比化学键的键能要小得多,而和分子间作用力的数量级相近,所以氢键是较强的分子间作用力。但氢键又与共价键相似,具有饱和性和方向性,而分子间作用力没有此性质。
二、氢键的类型
1、分子间氢键
一个分子的X-H键与另一个分子的原子Y相结合而成的氢键称为分子间氢键。能形成分子间氢键的物质除HF、H2O、NH3外,还有甲酸、乙酸等。另外氢键既可相接为链状,也可以层状或架状形式形成多聚体。如,(HF)n晶体和NaHCO3晶体中的氢键呈锯齿状,而冰中的氢键则为四面体架状结构。
2、分子内氢键
一个分子的X-H键与它内部的原子Y相结合而成的氢键称为分子内氢键。如,苯的邻位上有-CHO、-COOH、-OH、-NO2等可形成氢键自螯合环(氢键角稍偏180°,一般以五元或六元环较为稳定),硝酸分子内也能形成氢键。其情况图示如下:
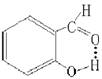
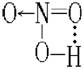
三、氢键对化合物性质的影响
氢键的强度虽然不如化学键大,但它毕竟是一种较强的有方向的分子间力,因而势必会影响到物质的某些性质。
1、对熔、沸点的影响
①分子间氢键可使物质的熔、沸点升高。因为它们的固体熔化或液体气化时,不仅要破坏分子间的范德华力,还必须提供额外的能量去破坏分子间的氢键。如上面提到的HF、H2O、NH3的熔、沸点在同族氢化物中反常地高。分子内氢键一般会使熔、沸点降低。
②对溶解度的影响
在极性溶剂中,如果溶质分子和溶剂分子之间能形成氢键,就会促进分子间的结合,导致溶解度增大。如氨在水中的溶解度特大,乙醇能与水以任意比混溶,皆源于此。如果溶液中溶质之间形成氢键,则能造成某种物质的溶解度降低,如钾、钠、铵的碳酸氢盐的溶解度反常地低于其对应的正盐。
③ 对硬度的影响
分子晶体中如有氢键,则会使硬度增大,如冰比一般分子晶体硬度大。
④ 对粘度的影响
液体中如有氢键,则粘滞性增大,如甘油的粘度大就是因为氢键。
⑤ 对酸性的影响
能与水分子形成氢键的酸酸性一般比较弱。如HF要比其它卤酸显著地弱。
总之,氢键是一种比较特殊的作用力,对物质的许多性质都有影响,但对于氢键还有许多问题尚不清楚,需进一步研究。

- 全部评论(0)
