反应热计算七法
时间:2018-10-08 20:58 来源:未知 作者:吴键 点击:次 所属专题: 反应热计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、比例法
热量的求算:化学计量数与△H绝对值成正比
例1 0.3mol的气态高能燃料乙硼烷(![]() )在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,写出其热化学方程式________________。
)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,写出其热化学方程式________________。
解析:根据书写热化学方程式的要求,写出热化学方程式并配平:![]()
可列出等式:![]() 解得
解得![]()
答案:![]()
![]()
二、定义法
定义法也可称为定“1”法,根据燃烧热或中和热定义求算
例2 含11.2g KOH的稀溶液与![]() 溶液反应放出11.46kJ的热量,该反应中和热的热化学方程式正确的是( )。
溶液反应放出11.46kJ的热量,该反应中和热的热化学方程式正确的是( )。
A. ![]()
B. ![]()
C. ![]()
D. ![]()
解析:根据中和热的定义:在稀溶液中,酸和碱反应生成“1mol水”时的反应热。![]() ,则
,则![]() 发生中和反应生成1mol水时放热
发生中和反应生成1mol水时放热![]()
答案:D
例3 已知下列热化学方程式①![]()
![]() ;②
;②![]()
![]() ;③
;③![]() ,则氢气的燃烧热为( )
,则氢气的燃烧热为( )
A. ![]() B.
B. ![]()
C. ![]() D. 无法确定
D. 无法确定
解析:根据燃烧热的定义:“1mol”氢气完全燃烧生成稳定的化合物“液态”水时所放出的热量。
答案:C
三、十字交叉法:
例4 已知:![]() ,且
,且![]() ,若A和D的混合气体1mol完全与B反应,反应热为
,若A和D的混合气体1mol完全与B反应,反应热为![]() ,则A和D的物质的量之比为( )。
,则A和D的物质的量之比为( )。
A. ![]()
B. ![]()
C. ![]()
D. ![]()
解析:由题意可知1molA与B完全反应的反应热为![]() ,1molD与B完全反应的反应热为
,1molD与B完全反应的反应热为![]() ,而1molA和D的混合气体完全与B反应,反应热为
,而1molA和D的混合气体完全与B反应,反应热为![]() ,运用十字交叉法:
,运用十字交叉法:
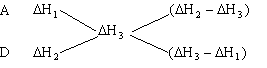
热量的差值之比,即为A和D的物质的量之比,
答案:B
四、不等式法(平衡移动法)
例5 已知298K时,![]()
![]()
![]() ,在相同温度下,向密闭容器甲中通入
,在相同温度下,向密闭容器甲中通入![]() 和
和![]() ,达到平衡时放出热量
,达到平衡时放出热量![]() ,向另一体积相同的密闭容器乙中通入
,向另一体积相同的密闭容器乙中通入![]() ,达到平衡时放出的热量
,达到平衡时放出的热量![]() ,则下列关系式正确的是( )
,则下列关系式正确的是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
解析:![]() 的反应是可逆反应,不可能进行到底,因此,甲容器反应达到平衡时放出热量
的反应是可逆反应,不可能进行到底,因此,甲容器反应达到平衡时放出热量![]() ,而乙容器在
,而乙容器在![]() 量不变,
量不变,![]() 量减少一半的情况下,平衡正向进行的趋势减小,因此
量减少一半的情况下,平衡正向进行的趋势减小,因此![]() ,
,
答案:C
五、整合法:盖斯定律
例6 已知下列热化学方程式
![]()
当1g液态水变成气态水时,其热量变化为:①放出②吸收③2.44kJ④4.88kJ⑤88kJ
A. ②⑤ B. ①③ C. ②④ D. ②③
解析:依据盖斯定律:化学反应不论是一步完成还是分几步完成,其反应热是相同的,将两个热化学方程式合并,写出液态水和气态水的热化学方程式:![]()
则1g水由液态变成气态时热量变化为![]() ,
,
答案D
六、拆分法
例7 根据热化学方程式(在![]() 时):
时):![]() ,分析下列说法中不正确的是( )。
,分析下列说法中不正确的是( )。
A. S的燃烧热为![]()
B. ![]() 放出热量大于297.23kJ
放出热量大于297.23kJ
C. ![]() 放出热量小于297.23kJ
放出热量小于297.23kJ
D. 形成![]() 的化学键所释放的总能量大于断裂
的化学键所释放的总能量大于断裂![]() 的化学键所吸收的总能量
的化学键所吸收的总能量
解析:根据题给燃烧热的热化学方程式可知A、D正确。若想确定B与C,需将题设热化学方程式拆分为:

![]() ,即放出热量的数值大于297.23kJ,
,即放出热量的数值大于297.23kJ,
答案:C
七、直接法
例8 在100gC不完全燃烧所得气体中,CO点1/3体积,![]() 占2/3体积且
占2/3体积且![]()
![]()
与这些碳完全燃烧相比,损失的热量是( )。
A. 392.92kJ B. 2489.4kJ C. 784.72kJ D. 3274.3kJ
解析:由题意可知,由于气体中CO未完全燃烧造成热量的损失,则此CO完全燃烧时释放的热量即为损失的热量。
![]()
答案:C

- 全部评论(0)
