例谈反应热大小比较的两种方法
时间:2018-10-08 20:56 来源:临沂市第十八中学 作者:段文娟 点击:次 所属专题: 盖斯定律 反应热计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
反应热大小比较是化学反应和能量变化这部分的常考题型,好多同学对这类题感觉无从下手,在这里介绍两种方法,希望能对读者起到帮助。
在这一章中经常会遇到这样的题:
在同温同压下,下列各组热化学方程式Q2>Q1的是( )
A.2H2(g)+O2(g)=2H2O(g);ΔH=-Q1
2H2(g)+O2(g)=2H2O(l);ΔH=-Q2
B.S(g)+O2(g)=SO2(g);ΔH=-Q1
S(S+O2(g)=SO2(g);ΔH=-Q2
C C(s)+0.5O2(g)=CO(g);ΔH=-Q1
C(s)+O2(g)=CO2(g);ΔH=-Q2
D.H2(g)+Cl2(g)=2HCl(g);ΔH=-Q1
0.5H2(g)+0.5Cl2(g)=HCl(g);ΔH=-Q2
对于C、D两个选项可根据反应方程式中的系数,系数越大,反应放出的热量也越多,C项Q2>Q1符合题意,D项Q1>Q2不符合题意。下面介绍分析A项和B项的两种方法。
方法一:图像法
同一种物质气态时能量高,液态是能量次之,固态时能量最低。
A项中两化学反应方程式反应物状态和系数都相同,只有产物状态不同,可得图像(如下图)
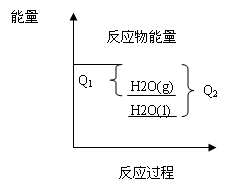
从图像中可以很容易的看出Q2>Q1,符合题意。
B项中两化学反应方程式只有硫的状态不同,可得图像(如下图所示)
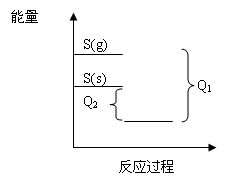
图中可以很容易的看出Q1>Q2,不符合题意。
答案:AC
方法二:利用盖斯定律:
A项中
①2H2(g)+O2(g)=2H2O(g);ΔH=-Q1,
②2H2(g)+O2(g)=2H2O(l);ΔH=-Q2
①-②可得:2H2O(l)=2H2O(g);ΔH=Q2-Q1
液态水转化为气态水为吸热过程,Q2-Q1﹥0,所以Q2>Q1,符合题意。
同理B项中
①S(g)+O2(g)=SO2(g);ΔH=-Q1
②S(s)+O2(g)=SO2(g);ΔH=-Q2
①-②可得:S(g)=S(s)H=ΔQ2-Q1
气态硫转化为固态硫为放热反应,Q2-Q1﹤0,所以Q1>Q2,不符合题意。
答案:AC

- 全部评论(0)
