热化学反应方程式的书写及计算
时间:2016-01-31 21:20 来源:未知 作者:张澳 点击:次 所属专题: 热化学方程式
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学反应热的相关问题在高中化学教材中出现的篇幅较小,然而却与能源问题紧密相关,能源问题已经成为当今社会的热点,涉及物理,化学,生物等多方面知识,也已经成为将来试题的命题热点,因此,我们在化学学习过程中应该加大对反应热计算方法的学习和研究,并能够理论联系实际,拓展思维,综合应用。
正确计算的前提是能够正确的书写热化学反应方程式:
一、热化学反应方程式的书写注意事项
①焓变数值应该与热化学方程式的计量系数对应。②正确书写焓变数值正负号,当反应放热时ΔH<0当吸热时ΔH>0。③正、逆反应的焓变数值相反。④热化学反应方程式是指该物质完全反应时所放出的热。⑤对于各步反应方程式中物质的存在状态应该完全相同的反应,才能按比例相加减,写出总反应方程式,然后进行计算。
二、反应热的计算方法
方法一:根据盖斯定律求算反应热。
【盖斯定律特点】用已经测定的反应热的数据来计算难以测量的或者不能测量的反应热,是一种间接求算反应热的方法。
【盖斯定律注意事项】①盖斯定律表面反应热取决于体系变化的始态和终态,与反应路径无关。②热效应与参与反应的各物质的本性、聚集状态、完成反应的物质数量,反应进行的方式、温度、压力等因素均有关系。③计算过程中参与加减计算的方程式必须是严格完整的热化学方程式。
【计算方法总结】通过热化学方程式的叠加,进行△H的加减运算。
例题1、在一定条件下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g) 2CO2(g); △H=-566kJ·mol-1
CH4(g)+2O2(g) CO2(g)+2H2O(1);△H=-890kJ·mol-1
又知由H2与O2反应生成液态H2O 比生成气态H2O 多放出44kJ/mol的热量。则CH4气
在空气中不完全燃烧热化学方程式正确的是
A、2CH4(g)+O2(g) CO2(g)+CO(g)+4H2O(1)△H=-1214kJ·mol-1
B、2CH4(g)+O2(g) CO2(g)+CO(g)+4H2O(g)△H=-1038kJ·mol-1
C、3CH4(g)+5O2(g) CO2(g)+2CO(g)+6H2O(1)△H=-1538kJ·mol-1
D、3CH4(g)+5O2(g) CO2(g)+2CO(g)+6H2O(g)△H=-1840kJ·mol-1
【答案】D
【解析】本题给出CO和CH4燃烧的热化学方程式,注意这两个方程式所对应的焓变数值并不是燃烧热的数值,解答本题首先要搞清楚什么事燃烧热:(1)概念:在101kPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。燃烧热的单位一般用kJ/mol表示。(2)注意事项:完全燃烧,是指物质中下列元素完全转变成对应的物质:C→CO2,H→H2O,S→SO2等。(3)表示意义:例如C的燃烧热为393.5kJ/mol,表示在101kPa时,1molC完全燃烧放出393.5kJ的热量。
根据燃烧热定义,我们看出CO的燃烧热为-566/2=-283 kJ ,而CH4完全燃烧生成的为液态水(最稳定化合物),其燃烧热为-890kJ。本题要得到甲烷不完全燃烧的热化学方程式,则
⑴2CO(g)+O2(g) 2CO2(g); △H1=-566kJ·mol-1
⑵CH4(g)+2O2(g) CO2(g)+2H2O(1);△H2=-890kJ·mol-1
⑶H2O(g)=H2O(l);△H3=-44.0kJ/mol
⑷CH4(g)+2O2(g) CO2(g)+2H2O(g);△H4=?
⑸CH4(g)+1.5O2(g) CO(g)+2H2O(1);△H5=?
根据盖斯定律:
⑷=⑵-⑶×2,可求△H4=-890kJ·mol-1+88.0kJ·mol-1=-802kJ·mol-1
⑸=⑵-(1)×0.5,可求△H5=-890kJ·mol-1+283.0kJ·mol-1=-607kJ·mol-1
A中△H=△H2+△H5=-1497kJ·mol-1,故A错,同理,B为-1321kJ·mol-1,C为-2104kJ·mol-1,D为-1840kJ·mol-1
方法二:根据键能大小求算反应热。
【键能计算反应热特点】化学反应的实质是旧键的断裂和新键的生成,其中旧键的断裂要吸收能量,其数值为负,新键的生成要放出能量,其数值为正。
【注意事项】计算反应物键能总和和生成物键能总和时,要搞清楚键物质本身的结构以及形成化合物的化学键总数。
【计算方法总结】化学反应的热效应(反应热)和键能的关系:△H =E1(反应物的键能总和)-E2(生成物的键能总和)。
例题2、科学家已获得了极具理论研究意义的N4分子,其结构为正四面体,与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN N键吸收941kJ热量,则( )
A.N4的熔点比P4高
B.1molN4气体转化为N2时要吸收748kJ能量
C.N4是N2的同系物
D.1molN4气体转化为N2时要放出724kJ能量
【答案】D
【解析】解答本题的关键在于正确的运用公式△H =E1(反应物的键能总和)-E2(生成物的键能总和),由于1molN4 分子中含有6molN—N,当其完全断裂时吸收热量为6×193=1158KJ,而形成2mol N2时,放出热量-2×941=-1882KJ,则1molN4气体转化为N2时要放出-1882+1158=724kJ能量。
方法三:根据图像及实验数据求算反应热。
【计算特点】根据图中或着表格中所给出的实验数据进行计算。
【注意事项】①热量的数值必须与方程式对应。②放热时焓变为负值,吸热时焓变为正值。
【计算方法总结】根据图像中给出的数据计算。
例题1、下图是198K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是( )
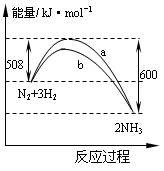
A.该反应的热化学方程式为:N2+3H2![]() 2NH3 ;△H=-92kJ·mol-1
2NH3 ;△H=-92kJ·mol-1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入2 mol N2和6mol H2反应后放出的热量为Q2kJ则184>Q2>2Q1
【答案】D
【解析】解答本题的关键在于正确认识图中所给出的数据,当氮气与氢气发生反应时,要翻越一个能垒,其能量数值为508kJ·mol-1 ,反应发生后,能量却要下降600 kJ·mol-1 而结合以前所学知识,我们知道合成氨反应是可逆反应,反应不能进行完全,这样能量也得不到完全的释放,故D正确。
例题2、学校某化学兴趣小组完成中和热的测定实验,分别取①50 mL 0.50 mol/L盐酸,50 mL 0.55 mol/L NaOH溶液,②50 mL 0.50 mol/L醋酸,50 mL 0.55 mol/L NaOH溶液,③50 mL 18.3 mol/L硫酸,50 mL 0.55 mol/L NaOH溶液计算反应放出热量的数值及大小关系。
【答案】①-57.3 kJ/mol ,② 小于-57.3 kJ/mol ,③大于-57.3 kJ/mol 。
【解析】本题为根据实验数据计算中和热,要解答此题,我们首先要弄清楚中和热的相关知识,(1)概念:在稀溶液中,酸跟碱发生中和反应而生成1 molH2O,这时的反应热叫中和热。(2)表示方法:H+(aq)+OH-(aq)=H2O (1); △H=-57.3kJ/mol。(3)注意事项: ①稀溶液是指溶于大量水的离子。②中和热不包括离子在水溶液中的生成热、电解质电离的吸热所伴随的热效应。③中和反应的实质是H+和OH-化合生成H2O,若反应过程中有其他物质生成,这部分反应热也不在中和热内。
根据本题数据,①氢氧化钠的物质的量略大,是由于氢氧化钠易吸收空气中的二氧化碳气体,但并不影响中和热的测定结果。②由于醋酸为弱酸,故电离要吸收热量,其放出的热量会小于-57.3 kJ ,③由于浓硫酸溶于水放大量的热,故放出的热量会大于-57.3 kJ 。

- 全部评论(0)
