化学实验中的晶体洗涤大有讲究
时间:2022-03-24 15:22 来源:未知 作者:王世坤 点击:次 所属专题: 沉淀洗涤 结晶05
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学高考试题中,经常涉及对所得晶体或固体残渣进行洗涤,洗涤大有讲究,要考虑几个方面,如:为什么要洗涤?用什么洗涤?怎样洗涤?怎样证明已经洗涤干净?等等。
一、关于洗涤的目的
关于晶体或残渣为什么要洗涤,即洗涤的目的,常见有:①除去杂质:除去晶体表面的可溶性杂质。②提高产率:洗涤过滤所得到的残渣,把有用的物质,如目标产物尽可能洗出来。③防止污染环境:如果滤渣表面有一些对环境有害的物质,如重金属离子或CN-,为了防止污染环境,往往对残渣进行洗涤。
例1(2009北京卷改编)以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
I从废液中提纯并结晶处FeSO4·7H2O;II将FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液;Ⅲ将浊液过滤;Ⅳ用90℃热水洗涤沉淀,干燥后得到FeCO3固体;V 煅烧FeCO3,得到Fe2O3固体。已知:NH4HCO3在热水中分解。
问题:IV(中为什么要用热水洗涤)?
解析:FeSO4溶液与稍过量的NH4HCO3溶液混合,在得到FeCO3的浊液里含有杂质离子SO42-和过量的NH4HCO3,由于NH4HCO3在热水中会分解,这样就除去了NH4HCO3,另外也可除去SO42-。所以,答案为:可以除去可溶性的杂质SO42-和NH4HCO3。
例2(2010江苏第16题):钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2]等。某主要生产BaCl2、、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下:
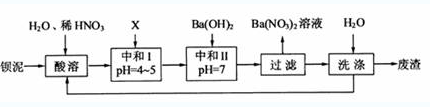
问题:上述流程中洗涤的目的是_____________ 。
解析:钡泥加入稀硝酸后BaCO3、BaSiO3变为Ba2+、CO2气体、H4SiO4(或H2SiO3)沉淀,BaSO3转化为BaSO4,Ba(FeO2)2转化为Ba2+和Fe3+,加入沉淀如BaCO3,可控制溶液的pH=4~5,把Fe3+转化为Fe(OH)3沉淀,接着加入Ba(OH)2可把少量的HNO3转化为Ba(NO3)2,这里洗涤的目的是把滤渣表面的硝酸钡除去,防止污染环境,这是标准答案。笔者认为把洗涤液又加入到初始的溶液中,相当于残液又被利用,提高了原料钡泥的利用率。所以,最佳答案为:减少废渣中可溶性钡盐对环境的污染;提高原料钡泥的利用率。
二、关于洗涤的试剂
对于用什么洗涤,我们经常可以用以下几种:①蒸馏水;②冷水;③有机溶剂,如酒精、丙酮等;④该物质的饱和溶液。一般经常用的洗涤剂是蒸馏水,如果用其他的洗涤剂,必有其“独特”之处。用冷水可适当降低晶体因为溶解而造成损失。用酒精等有机溶剂洗涤的好处常见有:可以降低晶体因溶解而造成损失,可以除去表面的可溶性杂质和水分;酒精易挥发,晶体易干燥。注意:有特殊的物质其溶解度随温度升高而下降的,可以采用热蒸馏水洗涤。用该物质的饱和溶液可以使因为溶解造成的损失降到最低。
例1(2005江苏高考试题):硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过下列实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
②向洗涤过的废铁屑加入过量的稀硫酸,控制温度50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体化学论文化工论文,用少量冰水2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
问题:实验步骤④中用少量冰水洗涤晶体,其目的是_____________;_______________。
解析:冰水作为洗涤剂,应该从两方面来说明。首先它是水,可以将某些可溶性的杂质溶解而除去;其次,要说明作为冰水温度低有什么好处。参考答案为:洗涤除去晶体表面附着的硫酸等杂质;用冰水洗涤可降低洗涤过程中FeSO4·7H2O的损耗。
例2(2011苏州高三调研)某实验小组在实验室按下列流程进行制取摩尔盐[(NH4)2SO4·FeSO4·6H2O]的实验:
问题:反应Ⅱ后的溶液经蒸发等操作所得固体用乙醇洗涤的目的是_____________。
解析:由于莫尔盐属于无机盐,在水中的溶解度大于在乙醇中,用乙醇洗涤可以降低莫尔盐因为溶解而造成损失;其次,由于水易溶于乙醇,用乙醇可以除去水,并把可晶体表面的杂质“冲走”;另外,酒精易挥发,很容易使晶体保持干燥。参考答案为:可降低莫尔盐因为溶解而造成损失;可除去表面的水分和一些杂质;酒精易挥发,晶体容易干燥。
三、关于洗涤的方法
洗涤的正确方法是:让过滤后的晶体继续留在过滤器中,加洗涤剂浸没过晶体,让洗涤剂自然流下,重复2-3次即可。注意点:在洗涤过程中不能搅拌,因为滤纸已经很润湿,如果搅拌就很容易搅破滤纸,这样晶体会淋失,从而造成晶体损失。
例题(2010江苏高考):下列有关实验原理或操作正确的是( )
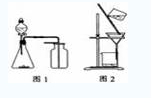
A.选择合适的试剂,用图1所示装置可分别制取少量CO2、NO和O2
B.制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸
C.洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干
D.用广泛pH试纸测得0.10mol·L-1NH4Cl溶液的pH=5.2
解析:此题易选C,其实C是错误的,因为洗涤沉淀时是不能搅拌的。A中NO不能用排空气法收集,A错;D中广泛pH试纸只能测到整数,D错;正确答案为B。
四、关于洗净的标志
对于洗涤干净的标志,可以采用物理方法,也可以化学方法。如果可溶性的杂质的水溶液有颜色,可以直接通过观看最后一次洗涤液是否有颜色化学论文化工论文,如果显无色,说明已洗涤干净,反之没有洗涤干净;对于含Na+、K+的可溶性杂质可以通过焰色反应来鉴别,从而判断有无洗涤干净;对于用物理方法无法判断的,可以通过化学方法来判断。方法是:取最后一次洗涤液来做实验。
例1(2011南京高三一模):富马酸亚铁(分子式C4H2O4Fe,结构简式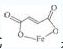 是一种可限量使用的铁强化剂。下图为实验室模拟工业制取富马酸亚铁的流程图:
是一种可限量使用的铁强化剂。下图为实验室模拟工业制取富马酸亚铁的流程图:
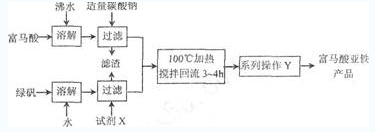
问题:操作Y 包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等。判断该操作中“洗涤”富马酸亚铁产品已洗净的实验方法是______。
解析:富马酸亚铁表面的可溶性杂质离子有Na+、SO42-等,可以从检验洗涤液中是否含Na+或SO42-来设计实验。参考答案为:取最后一次洗涤液,先加入稀盐酸,再加入氯化钡溶液,无白色沉淀生成,说明已洗涤干净。
总之,对实验过程中的一些操作如洗涤,多思考几个为什么,知其然,更要知其所以然,这样实验技能就会发生质的飞跃。

- 全部评论(0)
