氢键对物质的性质有何影响?
时间:2018-08-08 16:15 来源:未知 作者:吴星 点击:次 所属专题: 氢键02
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
高中化学课程标准中对氢键内容的学习提出了“列举含有氢键的物质,知道氢键的存在对物质性质的影响”的学习要求。为达到这一要求,中学化学教学中必须让学生了解:
•什么是氢键?氢键是如何形成的?
•如何判断物质中或物质之间是否存在氢键?
•氢键对物质的性质有哪些影响?
(1)氢键的形成
氢键(hydrogen bonding)通常是一种缺电子的H原子与富电子原子或原 子团之间的一种弱相互作用,比化学键的键能小得多,与范德华力较为接近。 通常情况下,氢键可以表示为“X— H┄Y”,其中X和Y—般都是电负性较大 的元素,且Y原子有1对或1对以上的孤对电子,X— H称为质子供体(pmton donor),Y称为质子受体(proton acceptor)。因此,形成氢键必须具备两个条 件:
(1)有一个与电负性很大而原子半径小的原子X形成强极性键的氢原子;
(2)同一分子内或另一分子中有一个电负性大、半径小、带孤电子对的原子Y, 一般符合条件的有F、O、N、S、Cl等原子。之所以要具备以上两个条件,是 因为当H原子与电负性大的X原子形成共价键X— H时,受X原子强电负性 的吸引,电子对偏向X原子一方,从而使H原子带部分正电荷,它可以与另一 电负性大的Y原子以静电引力相结合,形成“X— H┄Y”结构的键型。
1920年哈金斯(Huggins)首先提出氢键的概念后,拉梯麦尔(Latimer)和 罗德布什(Rodebush)用氢键理论解释水的反常沸点获得了成功。1935年X 射线晶体结构分析证明了氢键的存在。1939年,鲍林(Pauling)编著了《化学键的本质》一书,使氢键的概念被广泛接受。1951年蛋白质的α螺旋和β折叠结构的发现以及1953年DNA双螺旋结构中碱基对堆积作用的确认,使人们进一步认识到了分子间弱相互作用在生物大分子体系和生命过程中的作用, 人们对氢键的兴趣也越来越浓厚。
能形成氢键的物质相当广泛,在HF、H2O、NH3、 无机含氧酸、有机羧酸、醇、胺、蛋白质以及某些合成的高分子化合物等物质的分子之间或分子内都存在氢键。
随着对氢键研究的深入,多种类型的氢键不断被发现。例如π型氢键就是其中的一种。π型氢键是一 种带正电性的H原子与多重键的π电子或是共轭体系的π电子之间形成的一种弱相互作用。如F— H┄CH2 =CH2,ClC— H┄C6H6(见图3-16)等。
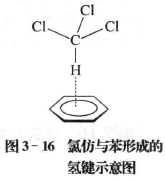
氢键具有下列特征:
•比化学键弱氢键的本质是静电作用,其键能一般在40 kJ • mol-1以下。 例如,在水分子中,O— H键的键能为463 kJ • mol-1,而在O—H┄O中氢键的键能为18. 8 kJ• mol-1。氢键的强弱与X和Y的电负性有关, X和Y的电负性越大,则形成的氢键越强。此外,氢键的强弱也与X和 Y的半径大小有关,X和Y的半径越小,形成的氢键越强。
•饱和性氢键中氢原子体积小,而X、Y原子体积较大。当H与X、Y 形成X—H┄Y后,如果再有第三个电负性较大的原子靠近氢原子时, 由于要受到X、Y原子电子云的强烈排斥作用,使得另一个电负性较大 的原子很难靠近氢原子,氢原子只能邻接两个电负性较大的原子,所以 氢键中氢的配位数一般为2,这就是氢键的饱和性。
•方向性氢键中X、H、Y三原子一般是在一条直线上,由于H原子体 积很小,为了减少X和Y之间的斥力,它们尽量远离,键角尽可能接近 180°(分子内氢键除外),这就是氢键的方向性。
(2)氢键对物质性质的影响
氢键对物质熔、沸点的影响
•对于结构相似的物质,若分子间形成氢键,则其熔、沸点升高。如碳族元素、氮族元素、氧族元素、卤族元素氢化物中,由于H2O、NH3、HF 分子间可形成氢键,使分子间产生较强的结合力,要使液体汽化或固体熔化,必须额外给予破坏分子间氢键的能量,故H2O、NH3、HF的熔、 沸点显著升高。而CH4分子间不能形成氢键,它的熔、沸点遵循同族元素的简单氢化物的递变规律。
•对于相对分子质量相近的物质,若分子间形成氢键,则熔、沸点较高,若分 子间不形成氢键,则熔、沸点较低。如相对分子质量相近的乙酸、丙醛、丙 酮、丙醇中,乙酸、丙醇能形成氢键,沸点较高(沸点分别为117. 9 ℃和97.4°C),而丙醛、丙酮不能形成氢键,沸点较低(沸点分别为48. 8 °C和 56 °C)
•当氢键存在于分子内部,则减少分子之间氢键的形成,使物质的熔、沸 点降低。如相对分子质量相同的邻、间、对硝基苯酚,由于邻硝基苯酚 分子内部羟基与硝基形成稳定的分子内氢键,而间硝基苯酚和对硝基 苯酚中羟基能形成分子间氢键,故邻硝基苯酚的熔、沸点较低,间硝基 苯酚和对硝基苯酚的熔、沸点较高。
氢键对物质溶解性的影响
若溶质分子与溶剂分子间能形成氢键,则溶质的溶解度增大。例如,乙醇 能与水完全混溶,而甲醚在水中的溶解度很小,就是因为乙醇分子中的一 OH 能与水分子中的O原子形成氢键而甲醚不能形成的缘故。若溶质分子形成分子内氢键,则在极性溶剂中的溶解度减小,在非极性溶剂中的溶解度增大。例 如,25 °C时,邻位与对位硝基苯酚在水中的溶解度分别为0. 2 g、1. 7 g。
氢键对液体黏度的影响
液体分子间如果形成氢键,分子间的作用力增大,黏度增大。例如,水的 黏度要比醚的黏度高;多羟基化合物如浓硫酸O2S(OH)2、浓磷酸OP(OH)3 等都是黏度较大的液体,其原因都是这些液体分子间可形成较多的分子间氢键。
氢键对物质酸性的影响
分子间形成氢键其酸性往往减弱,例如H2O、HF的酸性就远小于同族的氢化物的酸性;而分子内形成氢键,则往往使酸性增强。
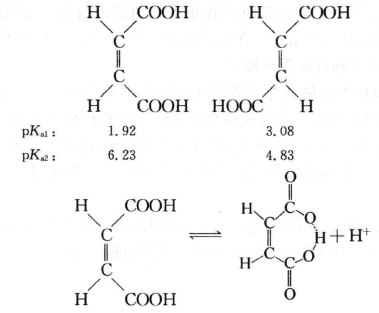
丁烯二酸的顺、反异构体的酸性相差较大,其原因是顺丁烯二酸一级电离 产生的酸根中存在分子内氢键。
氢键是一种非常重要的作用力,对物质的性质有着重要的影响,特别是在生命过程中的作用也很大。但在中学化学课程中,根据化学课程标准和化学教材,教学中只要求学生知道常见物质中是否存在氢键及氢键的存在对物质 的熔、沸点和溶解度有何影响。

- 全部评论(0)
(2640340846) 评论 氢键对物质的性质有何影响:简单明了 棒棒棒
