快速突破有机推断题的技巧与方法
时间:2020-06-05 11:16 来源:未知 作者:化学自习室 点击:次 所属专题: 有机推断
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、有机推断题的解题方法
1.解题思路:
原题![]()
![]()
![]() (结构、反应、性质、现象特征)
(结构、反应、性质、现象特征)![]() 结论←检验
结论←检验
2.解题关键:
(1)根据有机物的物理性质及特定的反应条件找突破口
(2)根据有机物之间的相互衍变关系寻找突破口
(3)根据有机物结构上的变化及某些特征现象寻找突破口
(4)根据某些特定量的变化寻找突破口
二、有机推断涉及的重要知识
1.由反应条件确定官能团:
利用特殊的反应条件,来确定物质所发生的反应类型及官能团的种类。
反应条件 | 反应类型及可能官能团 |
浓硫酸/Δ | ①醇的消去(醇羟基),醇脱水生成碳碳双键(170℃)或醚键(140℃)②酯化反应(含有羟基、羧基)③苯环的硝化、磺化④纤维素水解 |
稀硫酸或H+/Δ | ①酯的水解(含有酯基)②二糖、淀粉的水解③羧酸盐变成羧酸 |
NaOH水溶液/Δ | ①卤代烃的水解②酯类水解(油脂皂化)③可与-COOH、酚羟基反应 |
NaOH醇溶液/Δ | 卤代烃消去(-X)生成碳碳双键或碳碳叁键 |
H2/催化剂(Ni) | 加成(碳碳双键、碳碳叁键、醛基、羰基、苯环、油脂的氢化) |
O2/Cu或CuOΔ | 醇羟基(R-CH2OH变成醛,有些醇变成酮,有些醇不能发生催化氧化) |
Cl2(Br2)/Fe | 苯环上的氢原子(与苯环直接相连的氢原子)被取代 |
Cl2(Br2)/光照 | 烷烃或苯环上烷烃基上的氢原子被取代 |
碱石灰/Δ或固体NaOH/Δ | 脱羧反应:RCH2-COONa + NaOH |
水浴加热 | ①苯的硝化、磺化②银镜反应③制酚醛树脂④酯类水解⑤二糖的水解⑥蒸馏沸点较小的混合液 |
2.根据反应物性质确定官能团
反应条件 | 可能官能团 |
能与NaHCO3反应 | 羧基 |
能与Na2CO3反应 | 羧基、酚羟基 (☆酚羟基不能使指示剂变色) |
能与Na反应 | 羧基(最快)、酚羟基(较快)、醇羟基(缓和) |
与银氨溶液反应产生银镜 | ①醛基(醛类、甲酸、甲酸某酯、甲酸盐) ②葡萄糖、麦芽糖、果糖 |
与新制氢氧化铜产生砖红色沉淀(溶解) | 醛基(若溶解则含-COOH) |
使溴水褪色 | C=C、-C≡C-、或-CHO或酚类或无机反应 |
加浓溴水产生白色沉淀、遇Fe3+显紫色 | 酚(或含酚羟基的有机物) |
使KMnO4酸性溶液褪色 | C=C、C≡C、醇类、酚类、醛类、苯的同系物等 |
| A是醇(R-CH2OH)或乙烯 |
3.根据反应类型确定官能团
反应类型 | 可能官能团 |
加成反应/H2、HX、HCN等 | C=C、-C≡C-、(苯环、-CHO、羰基一般不与Br2加成) |
加聚反应 | C=C、-C≡C-及甲醛的加聚 |
单一物质能发生缩聚反应 | 分子中同时含有羟基和羧基或羧基和氨基(酚醛缩聚反应) |
取代反应 | ①苯的硝化、磺化②酯化反应 ③卤代烃的水解 ④蛋白质的水解⑤二糖、多糖的水解 |
消去反应 | ①醇的消去②卤代烃消去(可确定-OH或-x的位置) |
酯化反应 | 羟基或羧基(氨基酸中有羧基,无机酸脱-OH) |
水解反应 | 卤原子(-X)、酯基、肽键、二糖、多糖等 |
氧化反应 | 有机物得氧失氢的所有反应 |
还原反应 | 有机物得氢失氧的所有反应 |
4.根据定量数据推断
物质 | 试剂 | 定量关系 |
烯烃 | 与X2、HX、H2等加成 | 1mol 碳碳双键=1mol X2(HX、H2) |
炔烃 | 与X2、HX、H2等加成 | 1mol 碳碳三键=2mol X2(HX、H2) |
苯 | 与H2加成 | 1mol 苯环=3mol H2 |
醛 | ①与H2加成 ②与银氨溶液、新制氢氧化铜反应 | ①1mol-CHO=1mol H2 ②1mol-CHO=2mol Ag=1mol Cu2O |
醇/酚 | 与活泼金属(Na、Mg、Al等)反应 | 2mol-OH=2mol Na=1mol H2 |
羧酸 | ①与活泼金属Na、Mg、Al等反应 ②与Na2CO3溶液反应 ③与NaHCO3溶液反应 ④与醇发生酯化反应 | ①2mol-COOH=2mol Na=1mol H2 ②2mol-COOH=1mol Na2CO3=1mol CO2 ③1mol-COOH=1mol NaHCO3=1mol CO2 ④1mol-COOH=1mol-OH=1mol H2O |
A.分子量关系:
(1)每增加1个碳原子相当于减少12个氢原子,例如C9H20与C10H8就具有相同的分子量
(2)烷烃与较它少1个碳原子的饱和一元醛(酮)的相对分子质量相等。
(3)饱和一元醇与比它少一个碳原子的饱和一元羧酸的相对分子质量相等。
(4)某酸+乙醇→酯+nH2O 酯的式量比对应酸多28n
某醇+乙酸→酯+nH2O酯的式量比对应醇多42n
B.特定的式量:
(1)式量为28的有:C2H4 、N2 、CO
(2)式量为30的有:C2H6 、NO 、HCHO
(3)式量为44的有:C3H8 、CH3CHO 、CO2 、N2O
(4)式量为46的有:CH3CH2OH 、HCOOH 、NO2
(5)式量为60的有:C3H7OH、 CH3COOH、 HCOOCH3 、SiO2
(6)式量为74的有:CH3COOCH3 、CH3CH2COOH 、CH3CH2OCH2CH3、HCOOCH2CH3 、C4H9OH 、Ca(OH)2
C6H6式量为78
C.特定的量变关系:
(1)烃和X2取代反应中被取代的H和被消耗的X2之间的数量关系:n(X2)=n(H)
(2)RCH2OH→RHO→RCOOH
M M-2 M+14
(3)RCH2OH+CH3COOH→CH3COOCH2R +H2O
M 60 M+42 18
(4)RCOOH+CH3CH2OH→RCOOCH2CH3+H2O(酯基与生成水分子个数的关系)
M 46 M+28 18
5.根据单体与高分子的关系推断
(1)加聚:由不饱和有机小分子通过加成的原理,聚合成高分子化合物。特点:产物中主链原子一般全部是碳原子,且碳原子数是偶数;反应只生成高聚物,没有小分子H2O生成。
(2)缩聚:一般是有机小分子相互发生分子间脱水反应,聚合成高分子化合物。
特点:产物中主链碳原子除碳原子外,还可能有氧原子或氮原子(酚醛树脂除外);反应除生成高聚物外,还有小分子H2O生成。
主要缩聚(脱水)方式有以下几种:
①-COOH+HO-![]() -COO-
-COO-
②-COOH+H2N-![]() -CONH-
-CONH-
③-OH+ HO-![]() -O-
-O-
④酚醛树脂
三、有机合成涉及的重要知识
1.官能团的引入
引入官能团 | 有关反应 |
醇/酚羟基-OH | ①烯烃与水加成②醛/酮加氢③卤代烃(一卤代苯)的水解④酯的水解⑤葡萄糖在酒化酶作用下分解⑥酚盐在酸性条件下变成酚羟基 |
卤素原子(-X) | ①烃与X2取代②不饱和烃与Hx或X2加成③烯烃与X2在500℃取代④醇与HX取代⑤苯及苯的同系物与X2取代⑥苯酚与溴水反应 |
碳碳双键C=C | ①某些醇的消去②某些卤代烃的消去③炔烃的不完全加成 |
醛(羰)基-CHO | ①某些醇的催化氧化②烯烃氧化③糖类水解④炔烃水化 |
羧基-COOH | ①醛氧化(与O2、银氨溶液、新制氢氧化铜悬浊液反应)②酯酸性水解③羧酸盐酸化④醇、醛、苯的同系物被强氧化剂氧化⑤RCH2CN水化 |
酯基-COO- | 酯化反应 |
其中苯环上引入基团的方法:
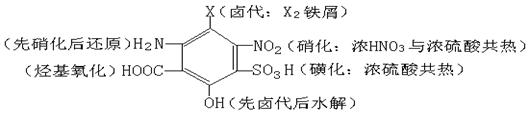
2.有机合成中的成环反应(注意开环反应)
类型 | 方式 |
酯成环(-COO-) | 二元酸和二元醇分子间的酯化成环 |
分子内酸醇的酯化成环 | |
醚键成环(-O-) | 二元醇分子内脱水成环 |
二元醇分子间脱水成环 | |
肽键成环 | 二元酸和二氨基化合物成环 |
氨基酸分子内或分子间脱水成环 | |
不饱和烃之间成环 | ①单烯和二烯加成②乙炔低度聚合 |
一元醛分子间成环 | 如乙醛聚合为六元环 |
3.生成高分子化合物:通过加聚反应或缩聚反应可获得高分子化合物。
4.有机合成中的增减碳链的反应:一般会以信息形式给出。
(1)增加碳链的反应:①酯化反应②加聚缩聚反应③醛与醛的加成④与HCN加成再水化
(2)减少碳链的反应:①水解反应:酯的水解,糖类、蛋白质的水解。②裂化和裂解反应
③氧化反应:燃烧,烯烃催化氧化(信息题),脱羧反应(信息题),苯的同系物氧化。
5.官能团的消除
(1)通过加成反应可以消除C=C键、-C≡C-键、醛基、羰基、苯环等不饱和键
(2)通过消去反应、氧化反应或酯化反应可以消除羟基(-OH)
(3)通过加成反应或氧化反应可以消除醛基(-CHO)、羰基
(4)通过消去反应或水解反应可以消除卤素原子
(5)通过水解反应可以消除酯基、肽键
6.官能团的衍变:根据有机合成需要(有时题目中会明示某些衍变途径),可进行有机物的官能团衍变,以使中间产物向产物递进。常见的有以下三种方法:
(1)利用官能团的衍变关系进行衍变,如RCH2OH→醛→羧酸
(2)通过某种化学途径使一个官能团变为两个,如CH3CH2OH→HOCH2CH2OH
(3)通过某种手段,改变官能团的位置,如CH3CH2CH2OH→CH3CH(OH)CH3
四、有机合成路线的选择
1.中学常见的典型有机合成路线
(1)一元合成路线(官能团的衍变)
R—CH=CH2 ![]() 卤代烃
卤代烃 ![]() 一元醇
一元醇 ![]() 一元醛
一元醛![]() 一元羧酸酯
一元羧酸酯
(2)二元合成路线
CH2=CH2 ![]() CH2X—CH2X
CH2X—CH2X![]() 二元醇
二元醇 ![]() 二元醛
二元醛 ![]() 二元羧酸
二元羧酸 
CH3CH2OH![]() CH2=CH2
CH2=CH2![]() CH2ClCH2Cl
CH2ClCH2Cl ![]() CH2OHCH2OH
CH2OHCH2OH
(3)芳香化合物合成路线:
①
![]()
②
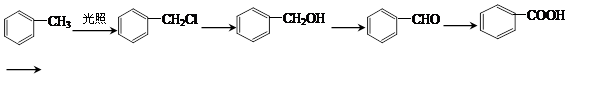
芳香酯
2.有机合成中常见官能团的保护
常见需保护的情况:
①氧化其它基团时先保护-OH、-CHO等
②加成时先保护-CHO
③对苯环邻位(或对位)取代时先保护对位(或邻位)
(1)酚羟基的保护:因酚羟基易被氧化,所以在氧化其它基团前可以使其与NaOH反应,把-OH变为-ONa(或-OCH3)将其保护起来,待氧化后再酸化将其转变为-OH。
(2)碳碳双键的保护:碳碳双键也容易被氧化,所以在氧化其它基团前可以利用其与HX的加成反应将其保护起来,待氧化后再利用消去反应转变为碳碳双键。
(3)氨基(-NH2)的保护:如在对硝基甲苯![]() 对氨基苯甲酸的过程中应先把-CH3氧化成-COOH之后,再把-NO2还原为-NH2。防止当KMnO4氧化-CH3时,-NH2(具有还原性)也被氧化。
对氨基苯甲酸的过程中应先把-CH3氧化成-COOH之后,再把-NO2还原为-NH2。防止当KMnO4氧化-CH3时,-NH2(具有还原性)也被氧化。

- 全部评论(0)
 RCH3+Na2CO3
RCH3+Na2CO3