高考中的热点物质
时间:2022-04-20 10:37 来源:未知 作者:化学自习室 点击:次 所属专题: 热点物质
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、变价金属
1.钒及其化合物
钒元素的常见价态有+5、+4、+3、+2,+5价最为稳定,常见的化合物为V2O5。
(1)V2O5有较强的氧化性,可以将浓盐酸氧化成氯气:V2O5+6HCl(浓)===2VOCl2+Cl2↑+3H2O
(2)+5价钒在强碱性溶液中以VO43-存在,酸性条件下以VO2+存在。VO2+可以被Fe2+、H2C2O4等还原为VO2+:VO2++2H++Fe2+===VO2++Fe3++H2O
2VO2++H2C2O4+2H+===2VO2+(蓝色)+2CO2↑+2H2O
2.铬及其化合物
铬元素的常见价态有+6、+3、+2。在酸性介质中,Cr2+具有强的还原性,Cr3+的还原性较弱,只有用强氧化剂才能将Cr3+氧化成Cr2O72-,+6价铬在酸性条件下以Cr2O72-存在,具有强氧化性,在碱性介质中以CrO42-存在。
(1)铬(Ⅵ)最重要的化合物是K2Cr2O7,在水溶液中Cr2O72-和CrO42-存在下列平衡;
2CrO42-(黄色)+2H+ Cr2O72-(橙红色)+H2O
Cr2O72-(橙红色)+H2O
在酸性溶液中,Cr2O72-具有强氧化性,如可以氧化浓盐酸,生成氯气:Cr2O72-+6Cl-+14H+===2Cr3++3Cl2↑+7H2O。但在碱性溶液中CrO42-的氧化性要弱得多。
(2)Cr(Ⅲ)在酸性条件下以Cr3+存在,碱性条件下以Cr(OH)3、[Cr(OH)4]-(或CrO2-)存在。
①Cr3+在酸性条件下是稳定的,只能被强氧化剂氧化,如:2Cr3++3PbO2+H2O===3Pb2++Cr2O72-+2H+,但在碱性条件下能氧化成CrO42-,2Cr3++3H2O2+10OH-===2CrO42-+8H2O。
②在碱性溶液中,CrO2-可以被H2O2氧化为CrO42-,2CrO2-+3H2O2+2OH-===2CrO42-+4H2O。
3.锰及其化合物
锰元素的常见价态有+7、+6、+4、+3、+2,Mn2+在酸性溶液中的稳定性强于在碱性溶液中的稳定性。
(1)Mn2+:在酸性条件下,很难被氧化,只有强氧化剂才能将其氧化,2Mn2++5PbO2+4H+===2MnO4-+5Pb2++2H2O;在碱性条件下,Mn2+易被氧化为MnO4-等,如5ClO-+2Mn2++6OH-===5Cl-+2MnO4-+3H2O。
(2)Mn(Ⅵ)化合物的性质
MnO42-存在于强碱性溶液中,在酸性、中性环境均发生歧化:
3MnO42-+2H2O===2MnO4-+MnO2↓+4OH-,
3MnO42-+4H+===2MnO4-+MnO2↓+2H2O。
(3)KMnO4的性质
热稳定性差,通常保存在棕色试剂瓶中:
4KMnO4+2H2O 4MnO2↓+3O2↑+4KOH
4MnO2↓+3O2↑+4KOH
①在酸性介质中,MnO4-具有强氧化性,可以氧化Fe2+、Cl-、H2C2O4、H2O2等,本身被还原为Mn2+。
如:MnO4-+5Fe2++8H+===Mn2++5Fe3++4H2O
②在碱性、中性或微弱酸性溶液中,MnO4仍旧是氧化剂,本身被还原为MnO2。
2MnO4-+I-+H2O===2MnO2↓+IO3-+2OH-
③在强碱性溶液中,当MnO4-过量时,还原产物是MnO42-,2MnO4-+SO32-+2OH-===2MnO42-+SO42-+H2O。
4.铅、锡及其化合物的性质
(1)铅及其化合物
①Pb:常温时Pb在空气中稳定存在,但表面易形成PbO和Pb2(OH)2CO3的保护膜;O2存在时可与醋酸反应,2Pb+O2+4CH3COOH===2(CH3COO)2Pb+2H2O;加热条件下与浓盐酸反应,Pb+4HCl(浓) H2[PbCl4]+H2↑。
H2[PbCl4]+H2↑。
②PbO、PbO2:均为两性氧化物,如PbO+2HCl===PbCl2+H2O,PbO+2NaOH+H2O===Na2[Pb(OH)4];PbO2具有氧化性,PbO2+H2O2+2H+===Pb2++O2↑+2H2O。
③Pb3O4:红色,可看作2PbO·PbO2,高温下分解,2Pb3O4 6PbO+O2↑;不溶于水,溶于热碱溶液,溶于酸时表现出氧化性,即Pb3O4+8HCl===4H2O+3PbCl2+Cl2↑。
6PbO+O2↑;不溶于水,溶于热碱溶液,溶于酸时表现出氧化性,即Pb3O4+8HCl===4H2O+3PbCl2+Cl2↑。
④PbS:方铅矿,3PbS+5O2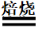 2PbO+PbSO4+2SO2。
2PbO+PbSO4+2SO2。
⑤PbSO4:难溶盐,在工艺流程中常将Pb杂质转化为PbO,然后用硫酸酸化转化为PbSO4而除去。
⑥(CH3COO)2Pb:实验室中用醋酸铅试纸检验H2S,H2S+(CH3COO)2Pb===PbS↓(黑色)+2CH3COOH。
(2)锡及其化合物
①Sn:与稀盐酸作用缓慢,加热条件下与浓盐酸反应较快,Sn+2HCl(浓) SnCl2+H2↑;与NaOH反应生成亚锡酸盐和H2,Sn+2NaOH===Na2SnO2+H2↑。
SnCl2+H2↑;与NaOH反应生成亚锡酸盐和H2,Sn+2NaOH===Na2SnO2+H2↑。
②Sn(OH)2:两性氢氧化物,可发生反应Sn(OH)2+2HCl===SnCl2+2H2O,Sn(OH)2+2NaOH===Na2SnO2+2H2O。
③SnCl2、SnCl4:均可水解,SnCl2+H2O===Sn(OH)Cl↓(白色)+HCl,SnCl4+4H2O===Sn(OH)4↓+4HCl。
5.钴、镍及其化合物
(1)钴及其化合物
①+2价钴的灰色氧化物CoO,可用作玻璃、陶瓷等的蓝色染料。黑色氧化物Co3O4中含有Co(Ⅱ)和Co(Ⅲ)。
②向Co2+盐溶液中加入碱先生成蓝色的Co(OH)2沉淀,这种蓝色的变体不稳定,放置或加热转化为粉红色Co(OH)2。Co(OH)2既与稀盐酸反应,又与氢氧化钠溶液反应,具有两性:
Co(OH)2+2HCl===CoCl2+2H2O
Co(OH)2+2NaOH(浓)===Na2[Co(OH)4]。
③Co(OH)2在碱性条件下或空气中很容易被氧化成Co(OH)3。但不论是Co(OH)3还是Co3O4,其中的Co(Ⅲ)在酸性介质中氧化性均很强,与盐酸作用放出Cl2:
Co3O4+8HCl(浓)===3CoCl2+Cl2↑+4H2O
2Co(OH)3+6HCl===2CoCl2+Cl2↑+6H2O。
④A.无水盐CoF2为红色,CoCl2为蓝色,CoBr2为绿色,CoI2为黑色。实验试剂用的多为粉红色的水合盐,如CoCl2·6H2O,CoSO4·7H2O和Co(NO3)2·6H2O。它们均可通过氧化钴与对应的酸反应制备。
B.利用CoCl2水合前后颜色的不同,将其掺入硅胶中作为硅胶含水量的指示剂。用于指示空气温度变化的“变色花”也是利用Co(Ⅱ)的这种性质。
C.铝板氧化层用极稀的Co(NO3)2溶液处理后灼烧,即显蓝色。这是由于硝酸钴分解生成的CoO与Al2O3作用生成蓝色的偏铝酸钴:CoO+Al2O3===Co(AlO2)2
⑤Co(Ⅲ)在酸性介质中的氧化性很强,可以将Mn2+氧化成MnO4:
5Co3++Mn2++4H2O===5Co2++MnO4+8H+
Co3+可以将H2O氧化,致使其在水溶液中不能稳定存在:
4Co3++2H2O===4Co2++4H++O2↑。
(2)镍及其化合物
①镍元素有化合价为+2的绿色氧化物NiO和绿色氢氧化物Ni(OH)2。尽管纯的Ni2O3尚未见报道,但是在NaOH介质中用溴氧化硝酸镍可以得到黑色的NiO(OH):
2Ni2++Br2+6OH-===2NiO(OH)↓+2Br-+2H2O
NiO(OH),其中镍的化合价为+3,是极强的氧化剂:
2NiO(OH)+6HCl===2NiCl2+Cl2↑+4H2O
Ni3+可以将H2O氧化,故在水溶液中不能存在。
②Fe(OH)2和Co(OH)2很容易被空气中的氧气氧化成高价,但是Ni(OH)2不能被空气所氧化。制备高价态的镍要使用强氧化剂在碱性介质中进行,而且在使用时制备为好,因为它不稳定。Co(OH)2和Ni(OH)2易溶于氨水生成配位化合物,其溶解度在有NH4Cl存在时增大。
③Ni2+水合盐晶体多为绿色,如氯化物NiCl2·6H2O,硫酸盐NiSO4·7H2O,硝酸盐Ni(NO3)2·6H2O。Ni2+的溶液主要用于金属材料的电镀保护。
二、化合物呈两性的金属——铍(Be)、锌(Zn)
1.类似铝的化学性质
(1)单质
①与酸反应:Be+2H+===Be2++H2↑
Zn+2H+===Zn2++H2↑
②与强碱反应:Be+2OH-===BeO22-+H2↑
或Be+2OH-+2H2O===[Be(OH)4]2-+H2↑
Zn+2OH-===ZnO22-+H2↑
或Zn+2OH-+2H2O===[Zn(OH)4]2-+H2↑
(2)氧化物
①与酸反应:BeO+2H+===Be2++H2O
ZnO+2H+===Zn2++H2O
②与碱反应:BeO+2OH-===BeO22-+H2O
ZnO+2OH-===ZnO22-+H2O
(3)氢氧化物
①与酸反应:Be(OH)2+2H+===Be2++2H2O
Zn(OH)2+2H+===Zn2++2H2O
②与碱反应:Be(OH)2+2OH-===BeO22-+2H2O
Zn(OH)2+2OH-===ZnO22-+2H2O
2.含铍、锌的盐的重要性质
(1)含铍的盐
Be2+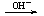 Be(OH)2
Be(OH)2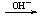 BeO22-
BeO22-
BeO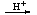 2H+Be(OH)2
2H+Be(OH)2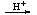 Be2+
Be2+
(2)含锌的盐
Zn2+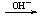 Zn(OH)2
Zn(OH)2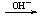 ZnO22-
ZnO22-
ZnO22-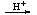 Zn(OH)2
Zn(OH)2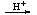 Zn2+
Zn2+
①可溶性锌盐(如ZnSO4)
A.与强碱溶液反应:
与少量NaOH溶液反应:Zn2++2OH-===Zn(OH)2↓
与足量NaOH溶液反应:Zn2++4OH-===[Zn(OH)4]2-
或Zn2++4OH-===ZnO22-+2H2O
B.与Na2[Zn(OH)4](或Na2ZnO2)反应生成Zn(OH)2沉淀
②Na2[Zn(OH)4](或Na2ZnO2)
与盐酸反应 | 少量 | Na2[Zn(OH)4]+2HCl===Zn(OH)2↓+2NaCl+2H2O 或Na2ZnO2+2HCl===Zn(OH)2↓+2NaCl |
足量 | Na2[Zn(OH)4]+4HCl===ZnCl2+2NaCl+4H2O 或Na2ZnO2+4HCl===ZnCl2+2NaCl+2H2O |
三、疫情防控中的含氯消毒剂
在防控新型冠状病毒期间,含氯消毒剂功不可没,常用的含氯消毒剂有84消毒液、漂白粉、消毒粉、含氯消毒剂泡腾片、二氧化氯等。

1.84消毒液
(1)是一种以次氯酸钠为主的高效消毒剂,主要成分为次氯酸钠(NaClO)。为无色或淡黄色液体,有效氯含量通常为5.5%~6.5%。1984年,地坛医院的前身北京第一传染病医院研制成功能迅速杀灭各类肝炎病毒的消毒液,经北京市卫生局组织专家鉴定,授予应用成果二等奖,定名为“84”肝炎洗消液,后更名为“84消毒液”。
(2)84消毒液一般通过Cl2与NaOH反应制得,Cl2+2NaOH===NaCl+NaClO+H2O,反应产物中的次氯酸钠是消毒液的主要成分。遇酸发生化学反应,较低的pH下释放氯气:HClO+HCl===Cl2↑+H2O,84消毒液需要避光保存,在光照下,它按下式分解:2HClO 2HCl+O2↑。
2HCl+O2↑。
2.漂白粉、漂白粉精
(1)漂白粉是氢氧化钙、氯化钙、次氯酸钙的混合物,主要成分是次氯酸钙[Ca(ClO)2],有效氯含量为30%~38%。漂白粉是由氯气与氢氧化钙(消石灰)反应而制得。
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。
漂白粉露置空气中容易失效:Ca(ClO)2+H2O+CO2===CaCO3+2HClO,2HClO 2HCl+O2↑。
2HCl+O2↑。
(2)漂白粉精又名高效漂白粉,主要成分是次氯酸钙,根据生产工艺的不同,还含有氯化钙或氯化钠及氢氧化钙等成分,有效氯含量为56%~60%。
3.含氯泡腾片
含氯泡腾片是以三氯异氰尿酸或二氯异氰尿酸钠等为有效成分的消毒片,有效氯含量为45%~55%;消毒泡腾片有效氯含量高,因呈固体所以运输、贮存、使用更为方便;
三氯异氰尿酸,化学式为C3O3N3Cl3,结构式为
 ,
,
水解产生次氯酸。
4.二氧化氯
ClO2是安全、无毒的绿色第四代消毒剂,是世界公认并得到世界卫生组织确认的A1级广谱、安全、高效消毒剂。对于新型冠状病毒具有很强的杀灭作用,而且可以快速地抑制病毒当中的蛋白质合成来破坏病毒,杀灭病毒。在消毒过程中不与有机物发生氯代反应,不产生“三致作用”(致癌、致畴、致突变)的有机氯化物或其他有毒类物质。
常见的制备方法有以下几种:
2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4
2NaClO2+Na2S2O8===2ClO2↑+2Na2SO4
5NaClO2+4HCl===4ClO2↑+5NaCl+2H2O
Cl2+2NaClO2===2ClO2+2NaCl
四、常考的含硫化合物
1.硫代硫酸钠(Na2S2O3)
Na2S2O3·5H2O俗名大苏打,它是无色透明的晶体,易溶于水,溶于水后呈碱性。
(1)Na2S2O3的化学性质
①与酸反应生成单质硫,放出SO2气体:
S2O32-+2H+===S↓+SO2↑+H2O。
②Na2S2O3是中等强度的还原剂,能被I2、Cl2、KMnO4等氧化剂氧化。
A.2Na2S2O3+I2===Na2S4O6+2NaI,此反应用于定量测定碘。
B.Na2S2O3+4Cl2+5H2O===Na2SO4+H2SO4+8HCl,此反应在纺织和造纸工业上作脱氯剂。
(2)Na2S2O3的制备方法
将Na2S和Na2CO3以物质的量比2∶1配成溶液,然后通入SO2,反应大致可分三步进行:
①Na2CO3和SO2反应生成Na2SO3:
Na2CO3+SO2===Na2SO3+CO2。
②Na2S与SO2反应生成Na2SO3和H2S:
Na2S+SO2+H2O===Na2SO3+H2S。
H2S是强还原剂,遇到SO2时析出硫:
2H2S+SO2===3S↓+2H2O。
③Na2SO3和S作用生成Na2S2O3:
Na2SO3+S===Na2S2O3。
将上面三步反应合并得到总反应:
2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2。
溶液蒸发浓缩后,冷却至293~303 K时即析出Na2S2O3·5H2O,用上述方法制得的Na2S2O3中常含有Na2SO4和Na2SO3等杂质。
制取硫代硫酸钠的另一种方法是在沸腾的状况下,使Na2SO3溶液同硫粉反应:Na2SO3+S Na2S2O3。
Na2S2O3。
2.几种重要的含硫化合物简介
(1)过二硫酸钠(Na2S2O8)
Na2S2O8中S元素的表现化合价为+7价,实质上S的化合价依然是+6价,其阴离子S2O82-结构中含有过氧键,其中2个O原子为-1价,其余6个O原子为-2价。因为有过氧键的结构,所以Na2S2O8是一种强氧化剂,在Ag+催化下,能将Mn2+氧化为MnO4-,反应的离子方程式为
2Mn2++5S2O82-+8H2O 2MnO4-+10SO42-+16H+。
2MnO4-+10SO42-+16H+。
(2)连二亚硫酸钠(Na2S2O4)
Na2S2O4俗称保险粉,S元素的化合价为+3价,具有还原性,在空气分析中常用来吸收氧气。
(3)焦亚硫酸钠(Na2S2O5)
S元素的化合价为+4价,与亚硫酸盐一样具有还原性。
A.制备:2NaHSO3 Na2S2O5+H2O。
Na2S2O5+H2O。
B.还原性:S2O52-+2I2+3H2O===2SO42-+4I-+6H+。
五、氮、磷和砷
1.联氨(肼,N2H4,结构式为 )
)
(1)碱性:二元弱碱,碱性比NH3的弱,在水中电离方式与氨相似,分两步进行:N2H4+H2O N2H5++OH-,N2H5++H2O
N2H5++OH-,N2H5++H2O N2H62++OH-
N2H62++OH-
(2)强还原性:
①水合肼在碱性溶液中能将银、镍等金属离子还原成金属单质,如:2N2H4·H2O+2Ag+===2Ag↓+2NH4++N2↑+2H2O
②能被O2、H2O2等氧化,可用作喷气式发动机推进剂、火箭燃料等。
2.次磷酸(H3PO2)和亚磷酸(H3PO3)
(1)次磷酸(H3PO2)
H3PO2是一元中强酸,并依下式电离:H3PO2 H++H2PO2-。次磷酸是一元酸的原因是结构中有两个氢原子直接与磷原子相连,不能电离,其电子式和结构式分别是:
H++H2PO2-。次磷酸是一元酸的原因是结构中有两个氢原子直接与磷原子相连,不能电离,其电子式和结构式分别是:
 。
。
H3PO2与足量的NaOH溶液反应的化学方程式为H3PO2+NaOH===NaH2PO2(正盐)+H2O
次磷酸和它的盐都有较强的还原性。
(2)亚磷酸(H3PO3)
H3PO3是二元中强酸,其结构式为
 ;
;
有还原性,如H3PO3+2Ag++H2O===H3PO4+2Ag↓+2H+。
3.砷的三种重要化合物
(1)砷化氢(AsH3)
砷化氢亦称为胂,是有大蒜气味的剧毒气体。可由金属砷化物水解或用强还原剂还原砷的氧化物制得:
Na3As+3H2O===AsH3↑+3NaOH
As2O3+6Zn+12HCl===2AsH3↑+6ZnCl2+3H2O
在缺氧条件下,砷化氢受热分解产生单质砷:
2AsH3 2As+3H2
2As+3H2
该反应是法医学上鉴定砷的马氏(mArSH)试砷法的化学根据。将锌、盐酸和试样混在一起,将生成的气体导入热玻璃管。如试样中有As2O3存在,生成的AsH3将受热分解,单质As在玻璃管壁生成黑亮的“砷镜”。
可用次氯酸钠溶液溶解玻璃管壁上的“砷镜”:
5NaClO+2As+3H2O===2H3AsO4+5NaCl。
(2)As2O3的性质
As2O3俗称砒霜,微溶于水生成亚砷酸(H3AsO3),可被过氧化氢氧化成砷酸(H3AsO4),属于两性氧化物:
As2O3+6NaOH===2Na3AsO3+3H2O,
As2O3+6HCl===2AsCl3+3H2O。
(3)As2S3的性质
As2S3俗称雌黄,可溶于碱性硫化物或碱溶液中:As2S3+3Na2S===2Na3AsS3,As2S3+6NaOH===Na3AsS3+Na3AsO3+3H2O。也可以与SnCl2、发烟盐酸反应转化为雄黄(As4S4):2As2S3+2SnCl2+4HCl===As4S4+2SnCl4+2H2S↑。雄黄和雌黄均可以与氧气反应生成As2O3。
六、硼的重要化合物
1.硼酸(H3BO3)
(1)硼酸具有片层状结构,层与层之间以范德华力联系在一起。根据硼的价电子层结构,层中的每个硼原子以3个sp2杂化轨道与3个OH基团结合成平面三角形结构的B(OH)3单元,各个B(OH)3单元之间通过氢键联结成层状结构,如图所示。

(2)硼原子以3个sp2杂化轨道与3个OH结合成B(OH)3单元,还有一个没有参加杂化的空的P轨道。当B(OH)3溶于水时,水解离出的OH-的孤对电子进入该p空轨道中,形成以b为中心的配位单元[B(OH)4]-,其配位数为4,结构为四面体,此时b的杂化方式变为sp3。于是水的解离平衡被破坏,其中c(H+)>c(OH-),水溶液显酸性。由显酸性的原理可以看出,硼酸是一元酸,且因为形成[B(OH)4]-的趋势不大,所以硼酸的酸性较弱,这一点可以从其平衡常数看出。
B(OH)3+H2O [B(OH)4]-+H+ Ka=5.81×10-10
[B(OH)4]-+H+ Ka=5.81×10-10
(3)硼酸遇到较强的酸时,可以显碱性,例如:
B(OH)3+H3PO4===BPO4+3H2O
硼酸受热失水的过程中,先生成偏硼酸{B3O3(OH)3},而后生成B2O3。
2.硼砂(Na2B4O7·10H2O)
(1)制备:将偏硼酸钠溶于水形成较浓溶液,然后通入CO2调节pH,浓缩结晶分离出硼砂:4NaBO2+CO2+10H2O===Na2B4O7·10H2O+Na2CO3。
(2)将硼砂溶于水,用硫酸溶液调节pH,可析出溶解度小的硼酸晶体:Na2B4O7+H2SO4+5H2O===4H3BO3↓+Na2SO4。
3.硼氢化钠(NaBH4)
硼氢化钠中的氢元素为-1价,具有还原性,故其可用作醛类、酮类的还原剂:
 。
。
七、草酸与草酸盐
1.H2C2O4的性质
(1)二元中强酸,酸性比碳酸的强。
(2)有较强的还原性,能使酸性高锰酸钾溶液褪色:2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O。
(3)不稳定,固体受热易分解:H2C2O4 H2O+CO↑+CO2↑。
H2O+CO↑+CO2↑。
2.草酸盐的性质
(1)(NH4)2C2O4溶于水,微溶于乙醇,加热分解,由氨水与草酸溶液作用而成。
(2)CaC2O4不溶于水、醋酸,溶于盐酸、稀硝酸;灼烧时转变成氧化钙。
(3)草酸镁、草酸亚铁等微溶于水,可由对应的可溶性金属盐与草酸铵在水溶液中作用而得,加热分解可得到对应金属氧化物。

- 全部评论(0)
