离子方程式错因透视
时间:2007-12-22 07:36 来源: 作者:黄瑞 点击:次 所属专题: 离子方程式正误判断
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
离子方程式正误判断是高考的重点、热点、渗透点。考查的目的主要是了解考生使用化学用语的准确程度和熟练程度,具有一定的综合性。下面结合近几年高考离子方程式正误判断试题,对题目中设置为错误的离子方程式的一些常见错误原因进行归纳、分析。
一、电荷不守恒
例1.Fe2(SO4)3 的酸性溶液中通入足量H2S
Fe3++H2S==Fe2++S↓+2H+
解析:离子方程式左边带3个单位正电荷,右边带4个单位正电荷,反应前后电荷不守恒。正确离子方程式应为2Fe3++H2S==2Fe2++S↓+2H+。
二、漏写部分离子反应
例2.MgSO4 溶液与Ba(OH)2 溶液反应
Ba2++SO42- ==BaSO4↓
解析:考生往往易注意Ba2+与SO42-反应, 题目故意漏写易忽视的Mg2+与OH-的反应, 正确离子方程式应为 Mg2++ SO42-+ Ba2++2OH-== BaS04↓+Mg (OH) 2↓。
三、化学式拆分错误
1.将难溶物写成离子形式
例3.Ca (H2PO4)2 溶液与澄清石灰水反应
H2PO4- + 2OH- == PO43-+2H2O
解析:Ca3(PO4)2 为难溶物,不能拆开写成离子形式,正确的应写成 3Ca2++2H2PO4-+ 4OH-== Ca3(PO4)2↓+ 4H2O。
2.将弱电解质写成离子形式
例4.CaCO3 溶于醋酸中
CaCO3+2H+== Ca2++ H2O+CO2↑
解析:醋酸是弱电解质,应写成 CH3COOH,而不能用H+来表示。
3.将可溶物写成化学式形式
例5.Ca(HCO3)2 溶液与盐酸反应
Ca(HCO3)2+2H+== Ca2++2H2O+2CO2↑
解析:Ca(HCO3)2 为可溶性盐,应拆开写成离子形式。
四、不符合反应实际情况
1.忽视反应物或生成物的氧化性、还原性强弱
例6.铁与盐酸反应
2Fe+6H+==2Fe3++3H2↑
解析:由于盐酸中H+氧化性弱,只能将Fe氧化成Fe2+。
例7.FeS固体放入稀硝酸中
FeS+2H+== Fe2++H2S↑
解析: Fe2+具有还原性,稀硝酸具有强氧化性,所以生成物不能是Fe2+, 应是 Fe3+。 -2价S有还原性,应被氧化。正确的离子方程式为 FeS+4H++NO3- == Fe3++NO↑+S↓+2H2O或FeS+4H++ 3NO3- == Fe3++3NO↑+ SO42-+2H2O。
例8.过量CI2通入FeBr2溶液中
CI2+ 2Fe2+=2Fe3+ +2CI-
解析:由于还原性Fe2+>Br-,又CI2过量,Fe2+、Br-全被氧化,故正确的应为3CI2 +2Fe2+ +4Br- ==2Fe3+ +6CI- + 2Br2。另外,若CI2少量,只氧化Fe2+,离子方程式为CI2 +2Fe2+==2Fe3+ + 2CI-;若通入的CI2 将Fe2+全部氧化成Fe3+,将Br-部分氧化成Br2时,离子方程式为2CI2+2Fe2++2Br-==2Fe3+ + 4CI-+ Br2。
例9.向FeI2溶液中加入少量溴水
3Br2+2Fe2+ +4I-== 2Fe3+ +6Br-+ 2I2
解析:因还原性I->Fe2+,Br2先氧化I-,待I-完全被氧化后再氧化Fe2+。Br2少量,只氧化I-,故正确的离子方程式为Br2 +2I-==2Br-+ I2。另外,若Br2过量,I-、Fe2+全被氧化,离子方程式为3Br2 +2Fe2+ +4I-== 2Fe3+ +6Br-+ 2I2;若加入的Br 2 将I-全部氧化,Fe2+部分氧化时,离子方程式为4Br2 +2Fe2+ +6I-== 2Fe3+ +8Br-+ 3I2。
例10. 向 Ca(CIO)2 溶液中通入SO2
Ca2++2CIO-+ SO2+H2O==CaSO3↓+2HCIO
解析:产物 CaSO3和 HCIO 之间能发生氧化还原反应,正确的应写成 Ca2++2CIO-+ SO2+H2O==CaSO3↓+HCIO+ H++CI-。
2.忽视反应物或生成物的酸性、碱性强弱
例11.苯酚钠溶液中通入少量CO2
2C6H5O- +CO2+H2O = 2C6H5OH↓+CO32-
解析:由于酸性H2CO3> C6H5OH > HCO3-,HCO3-比C6H5OH更难电离出H+,反之可知CO32-结合H+形成HCO3-的能力比C6H5O-结合H+形成C6H5OH的能力强,当C6H5OH游离出来后,溶液中肯定只有HCO3-而不会存在CO32-。因而向苯酚钠溶液中通入CO2只能生成NaHCO3,与通入的CO2的量无关,正确的应为C6H5O- +CO2+H2O== C6H5OH↓+HCO3-。由此还可知 C6H5OH + CO32- == C6H5O- + HCO3-。
例12.在溶液中NH4HSO3与等物质的量NaOH混合
NH4++ HSO3-+2OH-== SO32-+NH3↑+2H2O
解析:由于酸性 HSO3-> NH4+ ( 因 NH3 +HSO3- ==NH4++SO32- ),OH-应先与HSO3-反应,又为等物质的量混合,故离子方程式为HSO3-+ OH-== SO32-+2H2O。
例13.AICI3溶液中加入过量的氨水
AI3++4NH3·H2O==AIO2- +4 NH4++2H2O
解析:氨水是弱碱,AI(OH)3 不溶于过量的氨水,正确的应是 AI3++3NH3·H2O== AI(OH)3↓+3 NH4+。
3.忽视水解实质
例14.硫化钠水解
S2-+2H2O ==H2S↑+2OH-
解析:S2-的水解是微弱的可逆反应,且以第一步为主,正确的应为S2-+H2O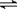 HS-+OH-。
HS-+OH-。
4.忽视难溶物溶解度大小的比较
例15.Mg(HCO3)2溶液中加入过量澄清石灰水
Mg2++2HCO3-+Ca2++2OH- == CaCO3↓+2H2O+MgCO3↓
解析:反应中石灰水过量,因此含有过量的OH-,又由于Mg(OH)2 的溶解度比MgCO3小,故生成物是Mg(OH)2而不是MgCO3。正确离子方程式为Mg2+ +2HCO3-+2Ca2+ +4OH-==2CaCO3↓+ Mg(OH)2↓+2H2O。
5.忽视反应物的用量
例16.Ca(CIO)2 溶液中通入过量的 CO2
Ca2++2CIO-+ CO2+H2O==CaCO3↓+2HCIO
解析:CaCO3可与过量的CO2 转化为 Ca(HCO3)2,正确的应写成 CIO-+ CO2+H2O== HCO3-+HCIO。
例17.在 Ca(HCO3)2 溶液中加入过量 NaOH 溶液
Ca2+ +HCO3- +OH- == CaCO3↓+ H2O
解析:酸式盐与碱反应的离子方程式的正误判断若涉及量的多少时,可依据是否符合“少定多变”原则。即离子方程式中,凡不足量的物质,其参加反应的阴、阳离子个数比,应等于化学式中这些离子的个数比(但有的离子方程式中由于某些离子如K+、Na+等实质上未参加反应而未写入方程式中,或者两种反应物均含有相同的离子,且都参加了反应时,会造成从方程式中不能直接看出不足量物质的阴、阳离子个数比与化学式中的比值一致),而过量物质的个数比,不一定等于化学式中的个数比。如果没有明确的用量,用任一反应物作为不足量分析出的离子方程式均属正确。该题中,由于 NaOH 过量,Ca2+和 HCO3-物质的量之比应是 1:2,正确的应写成Ca2+ +2HCO3- +2OH- == CaCO3↓+ CO32-+2H2O。
跟踪训练:
1.(2004年全国高考理综试题•河南等省区卷)下列离子方程式正确的是( )
A.澄清的石灰水与稀盐酸反应
Ca(OH)2 + 2H+ == Ca2+ + 2H2O
B.钠与水的反应
Na+2H2O == Na+ + 2OH-+ H2↑
C.铜片插入硝酸银溶液中
Cu + Ag+ == Cu2+ + Ag
D.大理石溶于醋酸的反应
CaCO3 + 2CH3COOH ==Ca2+ + 2CH3COO- +CO2↑+ H2O
2.(2004年上海高考化学试题)下列离子方程式中正确的是( )
A.硫化亚铁放入盐酸中
S2-+2 H+ == H2S↑
B.硫酸铜溶液中通入硫化氢
Cu2++H2S == CuS↓+2H+
C.氯化铝溶液中加入过量氯水
Al3++4NH3•H2O == AIO2-+4 NH4++2H2O
D.碳酸氢铵溶液中加入过量氢氧化钠溶液
HCO3-+OH- == CO32-+H2O
3.(2004年广东高考化学试题)下列离子方程式中,正确的是( )
A.在氯化亚铁溶液中通入氯气
Fe2++Cl2 == Fe3++2Cl-
B.三氯化铁溶液跟过量氨水反应
Fe3++3 NH3•H2O == Fe(OH)3↓+3 NH4+
C.碳酸氢钙溶液跟稀硝酸反应
Ca(HCO3)2+2H+ == Ca2++2H2O+2CO2↑
D.氯气通入冷的氢氧化钠溶液中
2Cl2+2OH-== 3Cl-+ClO-+H2O
4.(2005年全国高考理综试题•云南等省区卷)正确表示下列反应的离子方程式是( )
A.甲酸钠溶液和盐酸反应
HCOO-+ H+ == HCOOH
B.硫化钠的第一步水解
S2-+2H2O 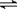 H2S+2OH-
H2S+2OH-
C.醋酸钡溶液和硫酸反应
Ba2++SO42- ==BaSO4↓
D.氢氧化钙溶液和碳酸氢镁反应
Ca2++OH- +HCO3-== CaCO3↓+H2O
5.(2005年上海高考化学试题)下列离子方程式中正确的是( )
A.碳酸氢钠溶液中加入盐酸
CO32-+2H+ == CO2↑+H2O
B.硫化亚铁与盐酸反应
S2-+2H+==H2S↑
C.苯酚钠溶于醋酸溶液
C6H5O-+CH3COOH == C6H5OH+CH3COO-
D.氯化亚铁溶液中通入少量氯气
CI2+ Fe2+==Fe3+ +2CI-
6.(2005年广东高考化学试题)下列反应离子方程式正确的是( )
A.向氯化铝溶液中加入过量氢氧化钠溶液
Al3++4OH- == AIO2-+2H2O
B.向苯酚钠溶液中通入二氧化碳
2C6H5O- +CO2+H2O == 2C6H5OH↓+CO32-
C.向小苏打溶液中加入醋酸溶液
HCO3- + H+ == CO2↑+ H2O
D.向溴化亚铁溶液中通入过量氯气
Fe2++2Br-+2CI2==Fe3+ + Br2+ 4CI-
7.(2005年广东高考综合试题)下列反应的现象描述与离子方程式都正确的是( )
A.金属镁与稀盐酸反应,有氢气产生
Mg+2H++2Cl-==MgCl2+H2↑
B.氯化钡溶液与硫酸反应,有白色沉淀产生
Ba2++SO42-==BaSO4↓
C.碳酸钠溶液与盐酸反应,有气泡逸出
Na2CO3+2H+==2Na++H2O+CO2↑
D.过量铁粉与氯化铁溶液反应,溶液变浅绿色
Fe+Fe3+ ==2Fe2+
8.(2005年江苏高考化学试题)下列离子方程式正确的是( )
A. 碳酸氢钠溶液与少量石灰水反应
HCO3-+Ca2++OH- == CaCO3↓+H2O
B.氯化氨与氢氧化钠两种浓溶液混合加热
NH4++ OH- H2O +NH3↑
H2O +NH3↑
C.氢氧化镁与稀硫酸反应
OH- + H+ == H2O
D.单质铜与稀硝酸反应
Cu+2H++2NO3- ==Cu2++2NO↑+H2O
参考答案:
1.D 2.B 3.B 4.A 5.C 6.A 7.B 8.B
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
