“物质的量”中一类值得注意的问题
时间:2008-03-06 13:34 来源: 作者:张楠 点击:次 所属专题: 物质的量
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
摩尔质量是单位物质的量的物质所具有的质量。教材指出:“1mol任何原子的质量,都是以克为单位,在数值上等于该原子的相对原子质量;1mol任何分子的质量,都是以克为单位,在数值上等于该分子的相对分子质量;1mol任何离子的质量,都是以克为单位,在数值上等于该离子的式量”。实际上此结论是以现有相对原子质量标准、阿伏加德罗常数标准为依据推导而得。若相对原子质量标准、阿伏加德罗常数标准其中之一发生变化,则摩尔质量在数值上一定不等于原子的相对原子质量、分子的相对分子质量、离子的式量;且相对原子质量标准、阿伏加德罗常数标准其中之一发生变化,还会导致一系列相关物理量的变化。
一、相对原子质量
相对原子质量标准表达式为:
一个原子的平均质量(kg)/一个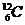 原子的质量(kg)×
原子的质量(kg)×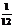 ,单位为1。
,单位为1。
由上式可以推导出:m1/m2 = Mr1/Mr2 ,即原子的质量之比等于相对原子质量之比。
当相对原子质量标准发生变化时,仅相对原子质量、相对分子质量、离子的式量随之变化,而摩尔质量却不发生变化。其它相关物理量(气体摩尔体积、物质的量浓度、1mol任何粒子所含粒子数等)也不发生变化。举例说明:
假设相对原子质量标准变为一个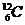 原子的质量(kg)×
原子的质量(kg)×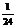 ,现有相对原子质量、相对分子质量、离子的式量均变为原来的2倍。然而由于阿伏加德罗常数标准并没有改变,因此碳原子的摩尔质量仍为12 g/mol。不妨设氧原子的摩尔质量是M g/mol,有:
,现有相对原子质量、相对分子质量、离子的式量均变为原来的2倍。然而由于阿伏加德罗常数标准并没有改变,因此碳原子的摩尔质量仍为12 g/mol。不妨设氧原子的摩尔质量是M g/mol,有:
12 g /M = 24 /32 解得,M= 16 g/mol。
这充分表明,相对原子质量标准发生变化,摩尔质量不会因此变化。摩尔质量在数值上也不再等于原子的相对原子质量、分子的相对分子质量、离子的式量。而是以克为单位,按上述新的原子质量标准,在数值上等于该原子的相对原子质量、分子的相对分子质量、离子式量的1/2 。
二、阿伏加德罗常数
阿伏加德罗常数是指0.012 kg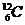 中所含碳原子数,常用“NA”表示。单位:mol-1。1mol任何粒子所含的粒子数就是0.012 kg
中所含碳原子数,常用“NA”表示。单位:mol-1。1mol任何粒子所含的粒子数就是0.012 kg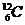 中所含碳原子数,即阿伏加德罗常数。NA ≈ 6.02×1023 mol-1。
中所含碳原子数,即阿伏加德罗常数。NA ≈ 6.02×1023 mol-1。
当阿伏加德罗常数标准发生变化时,仅摩尔质量、气体摩尔体积、物质的量浓度、1mol任何粒子所含粒子数随之变化,而相对原子质量、相对分子质量、离子的式量却不因此变化。举例说明:
假设阿伏加德罗常数变为0.024 kg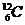 中所含碳原子数,单位:mol-1。则:1mol任何粒子所含的粒子数就是0.024 kg
中所含碳原子数,单位:mol-1。则:1mol任何粒子所含的粒子数就是0.024 kg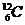 中所含碳原子数,即阿伏加德罗常数。NA ≈ 12.04×1023 mol-1。
中所含碳原子数,即阿伏加德罗常数。NA ≈ 12.04×1023 mol-1。
由于相对原子质量标准未发生变化,碳元素的相对原子质量、氧元素的相对原子质量分别为12、16。而此时碳原子的摩尔质量却是24 g/mol,不妨设氧原子的摩尔质量是M g/mol,有:24 g /M = 12 /16 解得,M= 32 g/mol。
由此可见,阿伏加德罗常数标准发生变化时,摩尔质量必然发生变化。按新的阿伏加德罗常数标准,摩尔质量是以克为单位,在数值上等于该原子的相对原子质量、分子的相对分子质量、离子式量的2 倍。
例1,若以0.024 kg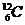 中所含碳原子数为阿伏加德罗常数,注意下列量的变化。
中所含碳原子数为阿伏加德罗常数,注意下列量的变化。
⑴.碳的相对原子质量为 12 ;
⑵.O2的摩尔质量为 64 g/mol ;
⑶.标准状况下气体摩尔体积为 44.8 L/mol ;
⑷.一定质量O2的物质的量为 原来的1/2 ;
⑸.一定质量的CO2 在标准状况下的体积 不变 ;
⑹.一定质量的Mg所含Mg原子个数 不变 。
例2, 假定把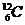 的相对原子质量定为24,并用以确定相对原子质量;以0.024 kg
的相对原子质量定为24,并用以确定相对原子质量;以0.024 kg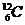 中所含碳原子数为阿伏加德罗常数。下列数值:①.浓H2SO4 的物质的量浓度;②.O2的溶解度;③.气体摩尔体积;④.阿伏加德罗常数;⑤.氧元素的相对原子质量; ⑥.O2的摩尔质量;⑦.CO2的相对分子质量。其中肯定不变的是 ( )
中所含碳原子数为阿伏加德罗常数。下列数值:①.浓H2SO4 的物质的量浓度;②.O2的溶解度;③.气体摩尔体积;④.阿伏加德罗常数;⑤.氧元素的相对原子质量; ⑥.O2的摩尔质量;⑦.CO2的相对分子质量。其中肯定不变的是 ( )
A. ①②⑦ B. ③④⑥ C. ④⑤⑦ D. ②
解析:本题同时改变了两个标准,与相对原子质量标准相关的数值都要发生变化,故⑤⑦变;阿伏加德罗常数变为原来的2倍,因此与NA有关的各个量①③④⑥均变,只有②不受影响。
答案:D 。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
