铝离子、氢氧化铝、偏铝酸根离子间的转化规律及应用
时间:2016-01-18 17:21 来源:未知 作者:孙法军 点击:次 所属专题: 铝反应图像 铝三角
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、三者之间的互变规律
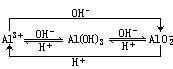
以上转化的实验、实验现象、离子方程式及图象如下。
1.Al3+与弱碱反应
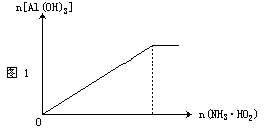
在可溶性铝盐溶液中逐滴滴入氨水至过量,反应生成白色沉淀,见图1。其离子方程式为:
2.Al3+与强碱反应
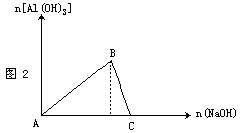
(1)在可溶性铝盐溶液中逐滴加入氢氧化钠溶液至过量,反应过程中先生成白色沉淀,随后沉淀完全溶解,见图2。其离子方程式为:
A→B:Al3++3OH-==Al(OH)3↓
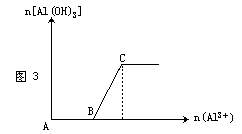
(2)向NaOH溶液中逐滴加入可溶性铝盐溶液至过量,反应一段时间后逐渐产生白色沉淀,见图3。其离子方程式为:
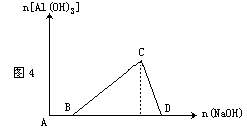
(3)向含有盐酸的AlCl3溶液中逐滴加入NaOH溶液至过量,反应一段时间后逐渐产生
白色沉淀,随后沉淀完全溶解,见图4。其离子方程式为:
A→B:H++OH-==H2O
B→C:Al3++3OH-==Al(OH)3↓
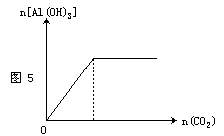
向偏铝酸钠溶液中逐渐通入二氧化碳至过量,反应生成白色沉淀,见图5。其离子方程式为:
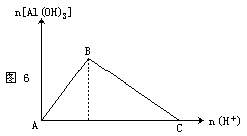
(1)向偏铝酸钠溶液中逐滴滴入稀盐酸至过量,反应过程中先生成白色沉淀,随后沉淀溶解,见图6。其离子方程式为:
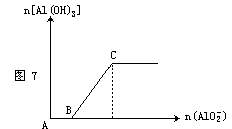
(2)向稀盐酸中逐滴滴入偏铝酸钠溶液至过量,反应一段时间后就逐渐生成了白色沉淀,见图
7。其离子方程式为:
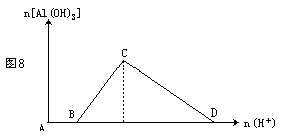
(3)向含有NaOH的NaAlO2溶液中逐滴滴入盐酸至过量,反应一段时间后就逐渐产生白色沉淀,随后沉淀溶解,见图8。其离子方程式为:
A→B:H++OH-==H2O
C→D:Al(OH)3+3H+==Al3++3H2O
从以上分析可得出下列结论:
①Al(OH)3既不溶于弱酸(如碳酸),也不溶于弱碱(如氨水),但可溶于强酸强碱,因此,它是一种两性氢氧化物。(由AlCl3溶液制Al(OH)3,用NH3·H2O比用NaOH好,将NaAlO2溶液转化为Al(OH)3,通CO2比用盐酸好。)
②Al3+只存在于强酸性溶液中,在弱碱性溶液中只转化成Al(OH)3沉淀,在强碱性溶液中,Al3+可转化为偏铝酸盐。
二、互变规律的应用
例题将50 mL a mol/L的NaOH溶液滴加到50mL b mol/L的AlCl3溶液中,试推导a与b的关系,并计算能得到Al(OH)3的物质的量。
解析由于NaOH和AlCl3的浓度是不定值,它们的反应可出现四种情况:(1)两者恰好完全反应;(2)AlCl3过量;(3)NaOH过量且生成的Al(OH)3完全溶解;(4)NaOH过量,生成的Al(OH)3部分溶解。
(1)NaOH和AlCl3恰好完全反应。
n(OH-)∶n(Al3+)=3
即0.05a=3×0.05b a=3b
(2)AlCl3过量,以NaOH的量为标准计算Al(OH)3的量。
n(OH-)∶n(Al3+)<3
即0.05a<3×0.05b a<3b
(3)当NaOH过量,生成的Al(OH)3完全溶解时,n(OH-)∶n(Al3+)≥4
即0.05a≥4×0.05b a≥4b
n[Al(OH)3]=0
(4)当NaOH过量,生成的Al(OH)3部分溶解时,Al3+以Al(OH)3
3<n(OH-)∶n(Al3+)<4
3×0.05b<0.05a<4×0.05b
3b<a<4b
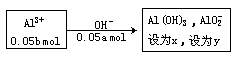
x=(0.2b-0.05a)mol

- 全部评论(0)
(3011381692) 评论 铝离子、氢氧化铝、偏铝酸:厉害大哥,很有用
~性·格(1798712455) 评论 铝离子、氢氧化铝、偏铝酸:讲的很仔细,给你点赞
