极值法专题
时间:2016-01-09 18:18 来源:未知 作者:汤芹 点击: 次 所属专题: 极值法 计算方法
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
极值法是把研究的对象或变化过程假设成某种理想的极限状态进行分析、推理、判断的一种思维方法;是将题设构造为问题的两个极端,然后依据有关化学知识确定所需反应物或生成物的量的解题方法。极值法的特点是“抓两端,定中间”。运用此法解题的优点是将某些复杂的、难于分析清楚的化学问题(如某些混合物的计算、平行反应计算和讨论型计算等)变得单一化、极端化和简单化,使解题过程简洁,解题思路清晰,把问题化繁为简,化难为易,从而提高了解题效率。以下结合部分试题谈谈运用极值法的几种策略。
策略一 把混合物假设为纯净物
1 用极值法确定物质的成分:
在物质组成明确,列方程缺少关系无法解题时,可以根据物质组成进行极端假设得到有关极值,并结合平均值原理确定答案。
例1:某碱金属R及其氧化物组成的混合物4.0g,与水充分反应后蒸发溶液,最后得到干燥固体5.0g,则该碱金属元素是( )
A. Li B. Na C. K D. Rb
解析:已知混合物各物质的相对分子质量,通常再有两个数据(即变化前后的量),就可以通过计算,推断出两种混合物的组成。本题虽有变化前后的两个数据,但缺少混合物各物质的相对分子质量(或相对原子质量),实际上是三个未知量,因此用二元一次方程组的常规解法无法得出结论。若通过列式对选项作逐一尝试,逐一淘汰的求解是很繁难的,而选取极值法进行求解,可受到事半功倍的效果。
把4.0g混合物假设为纯净物(碱金属单质R或氧化物),即可求出碱金属的相对原子质量的取值范围。
若4.0g物质全部是单质则:
R ~ ROH
M M+17
4g 5g
解得M=68
若4.0g物质全部是氧化物R2O则:
R2O ~ 2ROH
2M+16 2M+34
4g 5g
解得M=28
若4.0g物质全部是氧化物R2O2则:
R2O2 ~ 2ROH
2M+32 2M+34
4g 5g
解得M= -12
(由此可知过氧化物、超氧化物等复杂氧化物均不符合题意)因4.0g物质是单质及氧化物的混合物,则R的相对原子质量在28~68之间,而K的相对原子质量为39,故C符合题意。
2 用极值法确定混合物的组成:
在混合物成分分析时,可以将可能的成分极值化考虑,结合平均值原理与实际比较即可迅速判断出混合物的组成。
例2:(2007年全国卷Ⅱ—13)在一定条件下,将钠与氧气反应的生成物1.5g溶于水,所得溶液恰好能被80mL浓度为0.5mol/L的HCl溶液中和,则生成物的成分是( )
A.Na2O B.Na2O2 C.Na2O和Na2O2 D.Na2O2和NaO2
解析:利用极值法把生成物假设为某一种可能的氧化物进行计算。
n(Na+)=n(Cl-)=0.08L×0.5mol/L=0.04mol;当产物只有Na2O时,m(Na2O)=0.02mol×62g/mol=1.24g;当产物只有Na2O2时,m(Na2O2)=0.02mol×78g/mol=1.56g。
结合平均值原理可推出该反应生成物是Na2O和Na2O2的混合物。
例3:由Na、Mg、Al三种金属中的两种组成的混合物共10 g与足量的盐酸反应产生0.5g氢气,则此混合物中必定含有( )
A. Al B. Mg C. Na D.都有可能
解析:本题利用极值法把0.5g氢气看成是由单一的一种金属与盐酸反应产生。先求出Na、Mg、Al分别与足量盐酸产生0.5g 氢气所需的质量:
2Na ~ H2↑ Mg ~ H2↑ 2Al ~ 3H2↑
46 2 24 2 54 6
m(Na) 0.5g m(Mg) 0.5g m(Al) 0.5g
解得m(Na)=11.5g;m(Mg)=6g;m(Al)=4.5g。
再根据平均值原理知一定含有Na。故选C。
3 用极值法确定杂质的成分:
在确定混合物的杂质成分时,可以将主要成分和杂质极值化考虑(假设物质完是杂质或主要成分),然后与实际比较,即可迅速判断出杂质的成分。
例4:某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将6.9g样品溶于足量水中,得到澄清溶液。若再加入过量的CaCl2溶液,得到4.5g沉淀,对样品所含杂质的判断正确的是( )
A、肯定有KNO3和Na2CO3,没有Ba(NO3)2
B、肯定有KNO3,没有Ba(NO3)2,还可能有Na2CO3
C、肯定没有Na2CO3和 Ba(NO3)2,可能有KNO3
D、无法判断
解析:样品溶于水后得到澄清溶液,因此一定没有Ba(NO3)2。对量的关系用“极值法”可快速解答。设样品全为K2CO3,则加入过量的CaCl2溶液可得到沉淀质量为5g,;若6.9g全为Na2CO3则可得到沉淀质量为6.5g。显然,如果只含有碳酸钠一种杂质,产生沉淀的质量将大于5g;如果只含有KNO3,由于KNO3与CaCl2不反应,沉淀的质量将小于5g,可能等于4.5g。综合分析,样品中肯定有KNO3,肯定没有Ba(NO3)2,可能有Na2CO3。故本题选B。
策略二 把可逆反应极端地视为不可逆反应确定某物质的取值范围
由于可逆反应总是不能完全进行到底,故在可逆反应中分析反应物、生成物的量时利用极值法把可逆反应看成向左或向右进行完全的反应,这样可以准确、迅速得出答案。
例5:在密闭容器中进行的反应:X(g) + 4Y(g) ![]() 2P(g) +3Q(g),已知X、Y、P、Q初始的物质的量分别为0.1mol、0.4mol、0.2mol、0.3mol。在一定条件下,当反应达到平衡后,各物质的物质的量不可能的是( )
2P(g) +3Q(g),已知X、Y、P、Q初始的物质的量分别为0.1mol、0.4mol、0.2mol、0.3mol。在一定条件下,当反应达到平衡后,各物质的物质的量不可能的是( )
A、n(X)=0.15mol B、n(Y)=0.9mol C、n(P)=0.3 mol D、n(Q)=0.55mol
解析:通过讨论正、逆反应的两个极端(终端)结果,判断各物质的量的变化范围,进而作出正确的判断。假设反应向正反应方向完全进行到底,则
X(g) + 4Y(g) ![]() 2P(g) +3Q(g)
2P(g) +3Q(g)
起始量/mol 0.1 0.4 0.2 0.3
极限量/mol 0.2 0.8 0 0
假设反应向逆反应方向完全进行到底,则:
X(g) + 4Y(g) ![]() 2P(g) +3Q(g)
2P(g) +3Q(g)
起始量/mol 0.1 0.4 0.2 0.3
极限量/mol 0 0 0.4 0.6
由于反应的可逆性,反应完全进行到底是不可能的。因此,上述各物质的物质的量的变化范围是:0 < n(X) < 0.2、0 < n(Y) < 0.8、0 < n(P) < 0.4、0 < n(Q) < 0.6,故本题正确选项为B。
例6:在某条件下,容器内有如下化学平衡:A(g) + 4B(g) ![]() 2C(g) +D(g)。此时A、B、C的物质的量均为amol,而D的物质的量为dmol。(1)改变a的取值,再通过改变反应的条件,可使反应达到新的平衡,并限定达到新平衡时,D的物质的量只能在d/2~2d之间变化,则a的取值范围是______(用含a、d的式子表示)。
2C(g) +D(g)。此时A、B、C的物质的量均为amol,而D的物质的量为dmol。(1)改变a的取值,再通过改变反应的条件,可使反应达到新的平衡,并限定达到新平衡时,D的物质的量只能在d/2~2d之间变化,则a的取值范围是______(用含a、d的式子表示)。
解析: 如平衡逆向移动,采用极值法,D转化了d/2mol,即D在新平衡中的物质的量为(a-d/2)mol,转化关系如下:
A(g) + 4B(g) ![]() 2C(g) + D(g)
2C(g) + D(g)
旧平衡 a a a d
转 化 d/2 2d d d/2
新平衡 (a+d/2) (a+2d) (a-d) (a-d/2)
要求a-d﹥0即a﹥d。即a的取值范围是a﹥4d。
如平衡正向移动,采用极值法,转化生成D为dmol,即D在新平衡中的物质的量为2dmol,转化关系如下:
A(g) + 4B(g) ![]() 2C(g) + D(g)
2C(g) + D(g)
旧平衡 a a a d
转 化 d 4d 2d d
新平衡 (a-d) (a-4d) (a+2d) 2d
要求a-d﹥0、a-4d﹥0同时成立,即a﹥4d。
策略三 把平行反应分别假设成单一反应
若一个体系中同时存在几个反应,可以利用极值法分别假设全部发生其中一个反应从而求出两个极端值。
例7:在标准状况下,将NO2、NO、O2的混合气体充满容器后倒置于水中,气体完全溶解,溶液充满容器。若产物不扩散到容器外,则所得溶液的物质的量浓度为( )
A、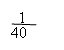 mol•L-1 B、
mol•L-1 B、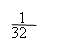 mol•L-1 C、
mol•L-1 C、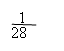 mol•L-1 D、
mol•L-1 D、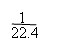 mol•L-1
mol•L-1
解析:本题考查学生对NO2、NO与O2混合气溶于水的计算能力。由于NO2和NO的量没有一个确定的关系,若用一般的列方程组法是很难得出结论的。因此我们只能利用极端法(把三种气体当作NO2与O2、NO与O2两种情况分析)求出溶液浓度范围,再根据选项确定答案。设烧瓶体积为V。
若仅为NO2与O2的混合气体,因4 NO2+O2+2H2O=4HNO3
则
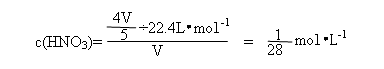
若仅为NO与O2的混合气体,因4 NO2+3O2+2H2O=4HNO3
则
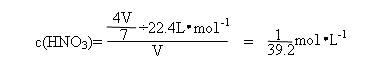
现为NO2、NO、O2三种气体混合物,生成c(HNO3)应介于二者之间,故选C。
策略四 用极值法把多个可能发生的反应假设为某一反应进行过量分析
1 当反应物以混合物的总质量或总物质的量已知时,可以利用极值假设全部是某一反应物,然后假设全部是另一反应物,再假设两者则好完全反应,从而得到解题的线索。
例8:18.4g NaOH 和NaHCO3固体混合物,在密闭容器中加热到250℃,经过充分反应后排除气体,冷却,称得剩余固体质量为16.6g,试计算原混合物中NaOH的质量分数。
解析:在密闭容器中进行的反应可能有:
NaOH+ NaHCO3 = Na2CO3+H2O -① 2NaHCO3 = Na2CO3+CO2↑+ H2O-②
40 84 106 168 106
究竟按何种情况反应,必须判断出NaOH与NaHCO3在反应①中何者过量,然后才能进行计算,借助极值法,能使判断方便直观。
设18.4g 固体全为NaOH,则受热不减少,剩余固体18.4g;设18.4g 固体全为NaHCO3,则按②反应,剩余固体(18.4g÷84 g/mol)×106 g/mol=11.6g;设18.4g 固体恰好按①完全反应,即混合物中m(NaOH)=18.4g×40÷(40+84),
则m(剩余固体)= 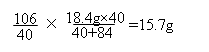 。 因现剩余固体16.6g,介于15.7g和18.4g之间,所以NaOH过量。
。 因现剩余固体16.6g,介于15.7g和18.4g之间,所以NaOH过量。
NaOH+ NaHCO3 = Na2CO3+H2O △m
40 84 106 18
x=8.4g 18.4g-16.6 g
m(NaOH)= 18.4g-8.4 g = 10 g m(NaOH)% = 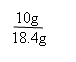 ×100% = 54.3%
×100% = 54.3%
2 在关于反应物的量不同可以发生不同反应的化学方程式的计算中,若题目已给出生成物的总质量或总物质的量时,可以利用极值法假设为全部发生某一反应求出产物的量,在结合题目所给数据判断最终产物,进而结合守恒关系可以求出各产物的量。
例9:(2005年上海卷—22)含8.0g NaOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是( )
A、Na2S B、NaHS C、Na2S和NaHS D、NaOH和NaHS
解析:本题采用极值法较简单。若没有反应产物全为NaOH时,质量为8g;若产物全部是Na2S时,质量为7.8g;若产物全部是NaHS时,质量为11.2g。实际产物为7.9g,则可能为NaOH和Na2S或Na2S和NaHS的混合物,故混合物中一定含有Na2S。
策略五 利用极限公式确定有机物的碳的质量分数
当题目给出一系列有机物的分子式(或结构式)求碳的质量分数最大(或最小)值时,可以先求出这一系列有机物的通式,然后分析碳的质量分数与碳原子数的关系(增函数或减函数),最后列式求极值。
例10: 在同系物C10H8(萘)、C16H10(芘)、C22H12(蒽并蒽)……中,碳的最大百分含量是( )
A、100% B、93.75% C、56% D、97.3%
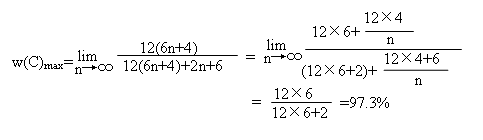
解析:根据萘、芘、蒽并蒽三者的分子式可以发现相邻的两物质相差C6H2,因此通式为C6n+4H2n+6。从通式分析,n值越大,碳的质量分数越高,当n趋于无穷大时,即得含碳质量分数最大值。
综上所述,极值法就是先将思路引向极端状况,使问题简化以顺利得出结论,然后再回过头来认识现实问题的方法。运用极值法解题的关键是紧扣题设的可能趋势,选好极端假设的落点。

- 全部评论(0)
