水解度
时间:2016-02-02 20:19 来源:未知 作者:黄勇 点击: 次 所属专题: 盐类水解规律 水解度
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
盐类的水解达到平衡时,已水解的盐的分子数与溶解在溶液中的盐的分子总数之比叫盐的水解度.各种盐在相同温度、相同浓度时有不同的水解度.水解生成的酸或碱越弱,则水解度越大.例如,18℃时0.1mol·L-1醋酸钠溶液的水解度是0.008%,而氰化钾在相同条件下的水解度是1.2%.这是由于氢氰酸比醋酸更弱的缘故.溶液越稀,一般水解度越大.在盐溶液中加入酸或碱,则水解度减小.水解是中和的逆反应,中和是放热反应,故水解是吸热反应,升温使水解度增大.由1价阳离子和1价阴离子形成的盐,其水解度h(以%计)可用下式计算:
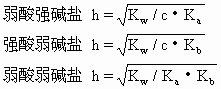
式中Kw是水的离子积,c是盐的物质的量浓度,Ka,Kb分别是弱酸和弱碱的电离常数.由上述公式可看出浓度及酸、碱的强弱对水解度的影响.
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
