关于弱电解质几个容易混淆的问题集
时间:2018-07-19 15:51 来源:未知 作者:陈艳丽 点击: 次 所属专题: 弱电解质
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一.弱电解质电离平衡问题
1.【实验结论】:
①强酸、弱酸加水稀释时,溶液的pH均增大,c(H+)均减小,溶液中的c(OH―)则均增大;强碱、弱碱加水稀释时,溶液的pH均减小,c(OH―)均减小,溶液中的c(H+)则均增大。
②强酸、强碱加水稀释时,溶液中离子物质的量不变(忽略水的电离);弱酸、弱碱加水稀释时,溶液中离子的物质的量增大(忽略水的电离)。
由以上实验结论得出,弱电解质的浓度减小,电离程度增大,但电离程度增大的程度不如浓度减小的程度,因而离子的浓度是减小的,只是离子的物质的量增加了。
③强酸、强碱加水稀释时,溶液的pH变化程度比弱酸、弱碱加水稀释时,溶液的pH变化程度大(利用这个特征可以区别强酸与弱酸或强碱与弱碱)。
④强酸溶液每稀释10倍溶液的pH增加1,强碱溶液每稀释10倍溶液的pH减小1。
2.稀释图像
将pH相同的盐酸与醋酸加水稀释溶液pH的变化如下图1,将pH相同的氢氧化钠与氨水加水稀释溶液pH的变化如下图2。
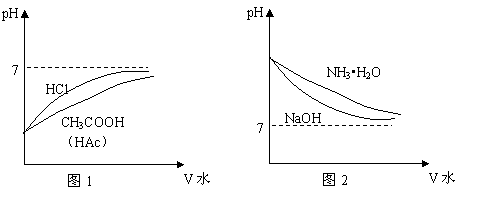
由上图可以分析出,将pH相同的盐酸和醋酸加相同的水稀释后,溶液的pH值是盐酸的较大。将pH相同的盐酸和醋酸加水稀释后,若要使稀释后溶液的pH仍相同,则醋酸中加的水较盐酸的多。
3.影响电离平衡的因素
以CH3COOH  CH3COO―+H+为例分析
CH3COO―+H+为例分析
改变条件 | 平衡移动方向 | 电离程度 | c(CH3COO―) | c(H+) | c(OH―) | pH |
升高温度 | → | ↑ | ↑ | ↑ | ↓ | ↓ |
加水 | → | ↑ | ↓ | ↓ | ↑ | ↑ |
加浓HCl | ← | ↓ | ↓ | ↑ | ↓ | ↓ |
*加冰醋酸 (无水醋酸) | → | ↓ | ↑ | ↑ | ↓ | ↓ |
加固体NaOH | → | ↑ | ↑ | ↓ | ↑ | ↑ |
加固体醋酸钠 | ← | ↓ | ↑ | ↓ | ↑ | ↑ |
*加冰醋酸即增大了醋酸浓度,平衡正向移动(即电离的醋酸分子数增多),但浓度增大,电离程度减小,原因在于溶液中醋酸的总量增大。电离程度可以理解为,电离的醋酸分子占醋酸总分子数的比例。
二.一元强酸、一元弱酸与二元强酸的比较问题
1.明确比较参量,即用什么量衡量
一般比较反应速率(快慢问题)用离子浓度(即:c(H+)),反应用量用物质的量总浓度(即c)
2.理清c(H+)与c的关系
一元强酸:c(H+)=c;二元强酸:c(H+)=2 c;一元弱酸:c(H+)<c(甚至c(H+)<<c)。
3.举例:
(1)等浓度(c相同),等体积的下列酸的比较
比较量 | CH3COOH(a) | HCl(b) | H2SO4(d) |
c(H+) | a<b=1/2d | ||
pH | a>b>d | ||
与相同金属反应开始时的速率 | a<b<d<> | ||
与足量金属反应产生氢气的量 | 2a=2b=d | ||
与酸反应所需金属的量 | 2a=2b=d | ||
中和所需NaOH的体积 | 2a=2b=d | ||
(2)pH相同。等体积的下列酸比较
比较量 | CH3COOH(a) | HCl(b) | H2SO4(d) |
c(H+) | a=b=d | ||
c | a>b=2d | ||
与相同金属反应开始时的速率 | a=b=d | ||
与足量金属反应产生氢气的量 | a>b=d | ||
与酸反应所需金属的量 | a>b=d | ||
中和所需NaOH的体积 | a>b=d | ||
金属与上述盐酸反应时,若盐酸过量,则醋酸更过量。
(3)与等量的NaOH溶液的所需酸的量比较
比较量 | CH3COOH(a) | HCl(b) | H2SO4(d) |
c相同时 | a=b=2d | ||
pH相同时 | a<b=d<> | ||
(4)pH相同,足量的盐酸与醋酸与金属(如:Zn)反应过程中的速率
若其它条件完全一样,pH相同,足量的盐酸与醋酸与金属开始时速率相同,但过程中平均速率则是醋酸大。因为醋酸的pH变化程度小,即c(H+)变化小,因而,反应开始后是醋酸溶液中的氢离子浓度更大些。
三.强酸与弱碱反应
1.常温下,0.1mol/L的HCl与0.1 mol/L的NH3•H2O等体积混合
恰好完全反应,生成的是NH4Cl溶液,溶液呈酸性,溶液中的c(NH4+<c(Cl-),c(H+)>c(OH-),pH<7。
2.若HCl与NH3•H2O混合后的溶液pH = 7
NH3•H2O稍过量,溶液呈中性,溶液中c(NH4+)=c(Cl―),c(H+)=c(OH―)。
3.将pH=3的HCl与pH=11的氨水等体积混合
NH3•H2O远远过量,溶液呈碱性,溶液中c(NH4+)>c(Cl―),c(H+)<c(OH-),pH>7。

- 全部评论(0)
