趣谈元素性质的对角线原理
时间:2013-04-09 10:47 来源:未知 作者:陈阳 点击: 次 所属专题: 对角线规则
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一般说来,碱金属和碱土金属元素性质的递变是很有规律的,但锂和铍却表现出反常性。锂、铍与同族元素性质差异很大,但是锂与镁,铍与铝在性质上却表现出很多的相似性。
在周期系中,某元素的性质和它左上方或右下方的另一元素性质相似性,称对角线规则。这种相似性特别明显地
存在于下列三对元素之间:
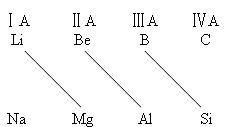
锂与镁相似性表现在:
① 锂和镁在过量的氧中燃烧时,并不形成过氧化物,而生成正常的氧化物。
② 锂和镁直接和碳、氮化合,生成相应的碳化物或氮化物。例如:
6Li + N2 ![]() 2Li3N
2Li3N
3Mg + N2 ![]() Mg3N2
Mg3N2
③ Li+和Mg2+离子都有很大的水合能力。
④ 锂和镁的氢氧化物均为中等强度的碱,在水中溶解度不大。加热时可分解为Li2O和MgO。其它碱金属氢氧化物均为强碱,且加热至熔融也不分解。
⑤ 锂和镁的硝酸盐在加热时,均能分解成相应的氧化物Li2O、MgO及NO2和O2,而其它碱金属硝酸盐分解为MNO2和O2。
⑥ 锂和镁的某些盐类和氟化物、碳酸盐、磷酸盐等均难溶于水,其它碱金属相应化合物均为易溶盐。
⑦ 氯化物都具有共价性,能溶于有机溶剂如乙醇中。它们的水合氯化物晶体受热时都会发生水解反应:
LiCl·H2O![]() LiOH +HCl(g)
LiOH +HCl(g)
MgCl2·6H2O![]() Mg(OH)Cl + 5H2O(g) + HCl(g)
Mg(OH)Cl + 5H2O(g) + HCl(g)
铍、铝相似性表现在:
① 两种金属的标准电极电势相近(Be2+/Be,-1.85V;Al3+/Al,-1.66V)。
② 铍和铝经浓硝酸处理都表现钝化,而其它碱土金属均易与硝酸反应。
③ 铍和铝都是两性金属,既能溶于酸也能溶于碱。
④ 氢氧化物均为两性,而其它碱土金属氢氧化物均为碱性。
⑤ BeO和Al2O3都有高熔点和高硬度。
⑥ 铝和铍的氯化物是共价分子,能通过氯桥键形成双聚分子,易升华、易聚合,易溶于有机溶剂。
对角线规则可用离子极化概念粗略地说明。一般来说,若正离子极化力接近,它们形成的化学键性质就相近,因而相应化合物的性质便呈现出某些相似性来。

- 全部评论(0)
