歧化反应与归中反应的几点质疑
时间:2016-11-09 09:26 来源:古田一中 作者:刘学超 点击: 次 所属专题: 氧化还原反应方程式 歧化反应 归中反应
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
几个常见的歧化反应与归中反应。
歧化反应:同一物质中同一价态的同一元素发生的氧化还原反应。
Cl2+2OH-==Cl-+ClO-+H2O,3Cl2+6OH- 5Cl-+ClO3-+3H2O,
5Cl-+ClO3-+3H2O,
3S+6OH- S2-+SO32-+3H2O,2Na2O2+2H2O==4NaOH+O2↑,
S2-+SO32-+3H2O,2Na2O2+2H2O==4NaOH+O2↑,
2NO2+2NaOH==NaNO3+NaNO2+H2O
归中反应:同种元素的不同化合物间发生的氧化还原反应。
Cl-+ClO-+2H+==Cl2↑+H2O,5Cl-+ClO3-+5H+==3Cl2↑+3H2O,
2H2S+SO2==3S↓+2H2O,S2-+SO32-+6H+==3S↓+3H2O,
S+2H2SO4(浓) 3SO2↑+2H2O
3SO2↑+2H2O
评价:从反应本质看,电子转移都是发生在同种元素的价态变化上。歧化反应价态分开:“中间价→高价+低价”;归中反应价态靠拢:“高价+低价→中间价”。
从反应类型看,歧化反应与归中反应都属于特殊的氧化还原反应。
从反应结果看,歧化反应与归中反应正好是相反的反应,归中又称反歧化。
问题1.发生分解的氧化还原反应一定是歧化反应吗?发生化合的氧化还原反应一定是归中反应吗?氧化还原反应一定是歧化或归中反应吗?
案例:如实验室催化加热氯酸钾制备氧气的反应2KClO3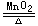 2KCl+3O2↑,此反应的变价元素有Cl、O两种,这与歧化反应同种元素价态变化相矛盾。而直接加热氯酸钾分解反应4KClO3
2KCl+3O2↑,此反应的变价元素有Cl、O两种,这与歧化反应同种元素价态变化相矛盾。而直接加热氯酸钾分解反应4KClO3 3KClO4+KCl,只有氯元素一种价态变化,属于歧化反应。故能发生分解的氧化还原反应不一定是歧化反应。
3KClO4+KCl,只有氯元素一种价态变化,属于歧化反应。故能发生分解的氧化还原反应不一定是歧化反应。
又如碳燃烧反应C+O2 CO2,此反应中C、O两种元素价态改变,这与归中反应同种元素价态变化相矛盾。而化合反应C+CO2
CO2,此反应中C、O两种元素价态改变,这与归中反应同种元素价态变化相矛盾。而化合反应C+CO2 2CO只有碳元素一种价态变化,属于归中反应。故能发生化合的氧化还原反应不一定是归中反应。
2CO只有碳元素一种价态变化,属于归中反应。故能发生化合的氧化还原反应不一定是归中反应。
氧化还原反应是个大概念,歧化或归中反应是氧化还原反应中的特例部分,故氧化还原反应不一定是歧化或归中反应。
问题2.常说“碱性歧化、酸性归中”,歧化反应一定要在碱性条件下进行吗?归中反应一定要在酸性条件下进行吗?
案例:如CaO+3C CaC2+CO↑与SiO2+3C
CaC2+CO↑与SiO2+3C SiC+2CO,两个反应均属于固体间碳元素的歧化反应,不在溶液中进行反应,无所谓碱性条件。2Na2O2+2CO2==2Na2CO3+O2,
SiC+2CO,两个反应均属于固体间碳元素的歧化反应,不在溶液中进行反应,无所谓碱性条件。2Na2O2+2CO2==2Na2CO3+O2,
2H2O2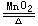 2H2O+O2↑,反应中氧元素发生歧化反应都不是在碱性条件下进行。再如,Cu2O+H2SO4==CuSO4+Cu+H2O,Na2S2O3+H2SO4==Na2SO4+SO2↑+S↓+H2O,反应中铜元素或硫元素的歧化反应却在酸性条件下进行。还有一些中间价态的非金属化合物发生分解反应或与水发生歧化反应:5HClO2==4ClO2+HCl+2H2O;Cl2+H2O==HClO+HCl,Br2+H2O==HBr+HBrO,3NO2+H2O==2HNO3+NO,3HNO2==HNO3+2NO+H2O等均不在碱性条件下进行。故歧化反应不一定要在碱性条件下进行。
2H2O+O2↑,反应中氧元素发生歧化反应都不是在碱性条件下进行。再如,Cu2O+H2SO4==CuSO4+Cu+H2O,Na2S2O3+H2SO4==Na2SO4+SO2↑+S↓+H2O,反应中铜元素或硫元素的歧化反应却在酸性条件下进行。还有一些中间价态的非金属化合物发生分解反应或与水发生歧化反应:5HClO2==4ClO2+HCl+2H2O;Cl2+H2O==HClO+HCl,Br2+H2O==HBr+HBrO,3NO2+H2O==2HNO3+NO,3HNO2==HNO3+2NO+H2O等均不在碱性条件下进行。故歧化反应不一定要在碱性条件下进行。
如NaH+H2O==NaOH+H2↑与NaH+NH3==NaNH2+H2,两个反应均属于氢元素的归中反应,均不在酸性条件下进行。又如,6NO2+8NH3==7N2+12H2O,6NO+4NH3==5N2+6H2O
5NH4NO3 4N2↑+2HNO3+9H2O,NH4NO3
4N2↑+2HNO3+9H2O,NH4NO3 N2O+H2O,这些氮元素的归中反应,不在溶液中进行反应,无所谓酸性条件。再如,NO+NO2+2NaOH==2NaNO2+H2O,反应中氮元素的归中反应却在碱性条件下进行。故归中反应不一定要在酸性条件下进行。
N2O+H2O,这些氮元素的归中反应,不在溶液中进行反应,无所谓酸性条件。再如,NO+NO2+2NaOH==2NaNO2+H2O,反应中氮元素的归中反应却在碱性条件下进行。故归中反应不一定要在酸性条件下进行。
所谓“碱性歧化、酸性归中”仅仅是反应的一般规律,说的是在碱性溶液中相对容易发生歧化反应,在酸性溶液中相对容易发生归中反应。具体在什么条件下会发生歧化或归中反应,主要取决于物质氧化性、还原性的强弱,由物质的电极电势定量判断,溶液的酸碱性会影响反应,但不是决定因素。
问题3.归中或歧化反应一定发生在非金属元素中吗?
案例:变价元素铁有0、+2、+3三种常见价态,+3价铁的化合物与单质铁可发生归中反应:2Fe3++Fe==3Fe2+;变价元素铜有0、+1、+2三种常见价态,+1价铜的化合物在溶液中可歧化反应:Cu2O+2H+==Cu+Cu2++H2O;变价元素锰有多种价态,既可发生歧化反应:3K2MnO4+2CO2==2KMnO4+MnO2↓+2K2CO3,又可发生归中反应:2KMnO4+3MnsO4+2H2O==5MnO2+K2SO4+2H2SO4,故归中或歧化反应不一定发生在非金属元素中,亦可发生在多变价的金属元素中。
问题4.歧化反应只发生在无机反应中吗?
案例:不含α-氢原子的脂肪醛、芳醛或杂环醛类在浓碱作用下醛分子自身同时发生氧化与还原反应,生成相应的羧酸(在碱溶液中生成羧酸盐)和醇的有机歧化反应,称之为康尼查罗反应。如2HCHO+NaOH HCOONa+CH3OH
HCOONa+CH3OH
应用:1.工业上从海水中提取单质溴的工艺流程为:
(1)向海水中通入Cl2,将海水中的溴化物氧化。
(2)向上述混合液中吹入热空气,将生成的溴蒸气吹出,用纯碱溶液吸收。
(3)将(2)所得溶液用H2SO4酸化,使NaBr,NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴,还可得到副产品Na2SO4。用化学方程式表示上述反应。
2.白磷化学式为P4,有剧毒。
(1)白磷能将Cu等不活泼金属从它们的盐溶液中还原出来,所以硫酸铜溶液是白磷中毒的解毒剂。写出有关反应的化学方程式。
(2)如果该反应是在加热条件下进行的,得到的还原产物是Cu3P,写出该反应的化学方程式。
(3)白磷在热的浓氢氧化钾溶液中岐化得到一种次磷酸盐和一种气体,写出有关反应的化学方程式。
3.(1)在真空中将CuO和硫粉混合加热可生成S2O和固体A,1mol CuO反应电子转移数为NA。写出该反应的化学方程式。
(2)若将S2Cl2与CuO加热,在100℃~400℃时,也能生成S2O,写出该反应的化学方程式。
(3)S2O在NaOH溶液中发生两种歧化反应,生成S2-、S2O42-、SO32-,写出这两种歧化反应的离子方程式。
(4)S2O也能在水中发生歧化反应,生成两种酸(两种酸酸性都不强),写出该反应的化学方程式。
4.(1)利用氧化还原法可消除汽车尾气中的NOX,其转化途径为:用O3氧化NO,生成的NO2用尿素[CO(NH2)2]处理可得到不污染空气的气体。写出这两个反应的化学方程式。
(2)大多数+1价铜的化合物是难溶物,如CuO、CuCl、CuH等。将CuH溶解在适量的稀硝酸中,产生两种无色气体,完成该反应的离子方程式。
(3)S2Cl2遇水强烈反应产生烟雾,其产物中有一种能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素的化合价发生变化,写出该反应的化学方程式。
(4)试管中残留的硫可以用热的NaOH溶液洗涤,S既是氧化剂,又是还原剂,生成两种强还原性盐。若3mol S8完全反应,转移电子32mol。写出该反应的离子方程式。
参考答案:1.(1)Cl2+2NaBr==2NaCl+Br2
(2)3Br2+3Na2CO3==5NaBr+NaBrO3+3CO2
(3)5NaBr+NaBrO3+3H2SO4==3Br2+3Na2SO4+3H2O
2.(1)P4+10CuSO4+16H2O==10Cu+4H3PO4+10H2SO4
(2)11P4+60CuSO4+96H2O 20Cu3P+24H3PO4+60H2SO4
20Cu3P+24H3PO4+60H2SO4
(3)P4+3KOH+3H2O 3Kh2PO2+PH3↑
3Kh2PO2+PH3↑
3.(1)2CuO+2S S2O+Cu2O
S2O+Cu2O
(2)S2Cl2+CuO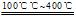 S2O+CuCl2
S2O+CuCl2
(3)5S2O+14OH-==S2-+3S2O42-+7H2O
2S2O+8OH-==S2-+2SO32-+4H2O
(4)5S2O+7H2O ==4H2S+3H2S2O4
4.(1)O3+NO==NO2+O2,6NO2+4CO(NH2)2==7N2+4CO2+8H2O
(2)6CuH+16H++4NO3-==6Cu2++4NO↑+3H2↑+8H2O
(3)2S2Cl2+2H2O==4HCl +SO2↑+3S↓
(4)3S8+48OH-==1S2-+8SO32-+24H2O

- 全部评论(0)
