如何判断分子或离子中的大π键?
时间:2019-05-14 09:42 来源:未知 作者:化学自习室 点击: 次 所属专题: 大π键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1. 什么是大π键?
在多原子分子中,如有相互平行的p轨道, 它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π 键或共轭大π键。
2. 形成大π键的条件是什么?
1.这些原子都在同一平面上;
2.这些原子有相互平行的p轨道;
3.p轨道上的电子总数小于p轨道数 的2倍。
3. 如何表示大π键?
如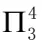 指平行于p轨道的数目有3个(一般粒子有几个原子,就是几个p轨道),平行p轨道里的电子数为4。
指平行于p轨道的数目有3个(一般粒子有几个原子,就是几个p轨道),平行p轨道里的电子数为4。
4. 如何计算大π键中的电子数?
1.确定分子中总价电子数;
2.计算分子中的σ键和不与π键p轨 道平行的孤对电子(含中心和外围中的 电子数);
3.总电子数减去这些键和孤对电子,剩余的就是填入大π键的电子。
5. 举例说明
例1:CO2中的大π键:
分析:(1)CO2中C原子为sp杂化,两端的O原子可视为不杂化。
(2)C原子sp杂化轨道为两个能量相等的Px轨道,其中各含有1个成单电子;Py轴上有1个成单电子;Pz轴上也有1个成单电子。
(3)O原子2s2、2p轨道中其中一个轨道上面均为两个自旋相反的电子。另两个P轨道上的成单电子分别与C原子的sp杂化轨道形成δ键和π键。
(4)第一套:y轴从左至右的电子数为:1、1、2,共4e-;第二套:z轴从左至右的电子数为:2、1、1,共4e-;均为三个P轨道,故CO2中存在两套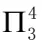 的大π键。
的大π键。
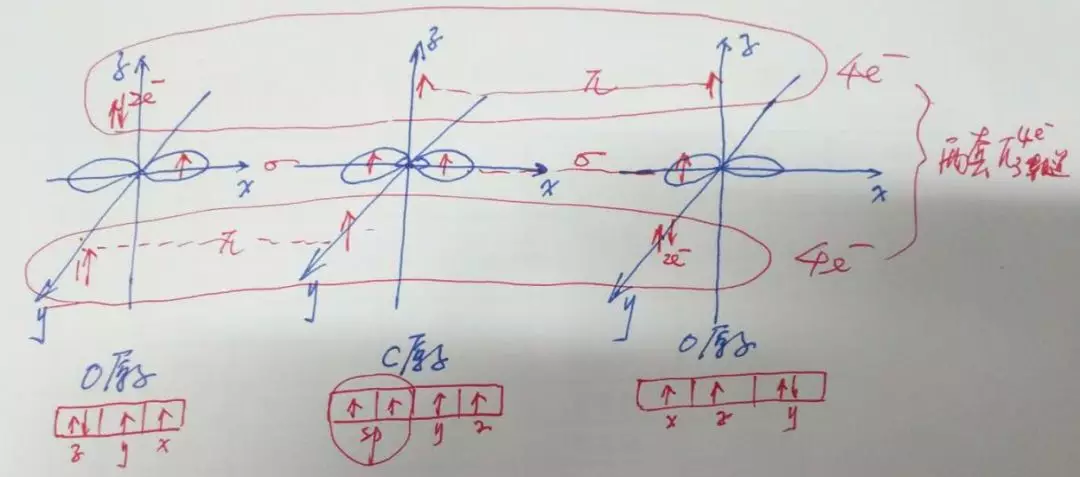
另计算如下:(中心原子C不存在孤对电子)
(1)CO2中的价电子总数为4+6×2=16。
(2)C与O形成δ键的电子数为2×2=4。(C和O各拿出1个电子,共2组)
(3)成对电子O原子中:2s、2p中有一个轨道中存在一对孤对电子(共4个),2个O原子共有:4×2=8。
(4)形成大π键的电子,即为剩余电子,共有:16-4-8=4。
(5)O、C、O原子的每个原子的某一p轨道中共有4个电子可共享,即大π键为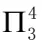 。
。
例2:NO3-中的大π键:(中心原子N不存在孤对电子)
(1)NO3-中的价电子总数为5+6×3+1=24。
(2)N与O形成δ键的电子数为3×2=6。(N和O各拿出1个电子,共3组)
(3)成对电子O原子中:2s、2p中有一个轨道中存在一对孤对电子(共4个),3个O原子共有:4×3=12。
(4)形成大π键的电子,即为剩余电子,共有:24-6-12=6。
(5)O、O、N、O原子的每个原子的某一p轨道中共有4个电子可共享,即大π键为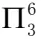 。
。
例3:O3中的大π键:(中心原子O存在一对孤对电子)O3可以看成O·O2。
(1)O3中的价电子总数为6×3=18。
(2)中心O与另两个O原子形成δ键的电子数为2×2=4。
(3)中心O存在一对孤对电子。
(4)成对电子O原子中:2s、2p中有一个轨道中存在一对孤对电子(共4个),2个O原子共有:4×2=8。
(5)形成大π键的电子,即为剩余电子,共有:18-4-2-8=4。
(6)O、O、O原子的每个原子的某一p轨道中共有4个电子可共享,即大π键为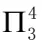 。
。
提醒:中心原子若有孤对电子,一定要把孤对电子从价电子总数中减去。
说明:如果能画出草图,则可更好地理解各个原子之间的成键情况。如果画不出,只能通过公式进行计算,而不必管电子是如何填入轨道中的。
归纳:可以简单的计算如下:
(1)先计算粒子的总价电子数(m);
(2)计算原子之间的δ键,一对δ键存在2个电子(n);
(3)中心原子的孤对电子数(o);
(4)外围原子的价层电子中的孤对电子数,如O原子为2s、2p中各有1对,共4个电子(p)。
(5)大π键的电子,剩余电子,共有:b=m-n-o-p。
(6)表示:共有几个原子参加,则即有几个p轨道平行,数目为a,大π键表示为: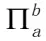 。
。
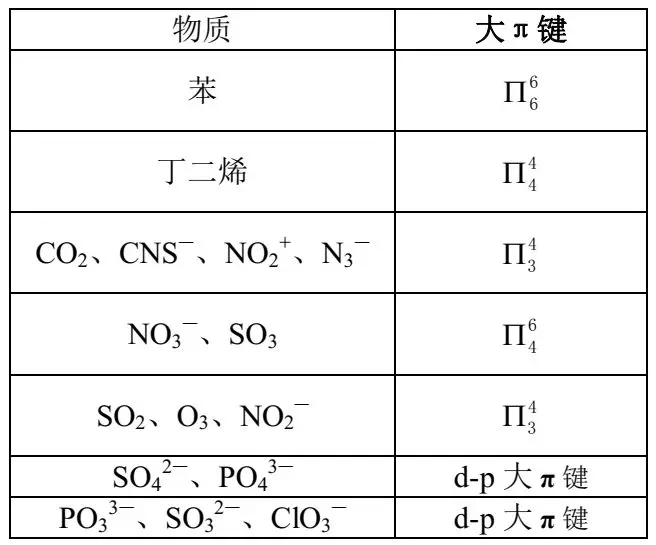
6. 常见物质中的大π键

- 全部评论(0)
(1873700795) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:可以的,你再看看
(1986312443) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:四硼酸钠有大π键吗
(215787118) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:但是BF3与碳酸根 三氧化硫 硝酸根是等电子体
(1875104989) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:BF3按照此法算不出来
(1227196163) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:错了,应该是派下4上6
(1667942172) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:与SO3是等电子体
(871523589) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:孤对电子结算公式可以得到 确实没有
(3572651322) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:6-(2×2)然后除以2=1个孤电子对
(2899767341) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:想问一下丁二烯为什么是4个原子共用电子,为什么不是10个原子
(1659752235) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:举例中,硝酸根的大π键表示错了吧,
(2667147056) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:那个 我想问一下 CO2中 为啥不可以是 一个π33,一个π35. 也就是
(419067360) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:上面的讲解2和表格不一样啊,硝酸根离子为啥没有孤电子对?
(2971420354) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:为什么臭氧中中心氧原子有一个孤电子对?
(2971420354) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:为什么臭氧中中心氧原子有一个孤电子对?
(2544696753) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:棒棒哒,这讲解。
黄玉玲(76543293) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:为什么硝酸根中的氮原子不提供孤电子对?
Hi,小蜗(2857118328) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:懂了,谢谢
Hi,小蜗(2857118328) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:二氧化碳和硝酸根不是也有孤对电子吗
否(1455270775) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:二氧化氮的也算不对
否(1455270775) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:硝酸的为什么也算不对?
否(1455270775) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:硝酸的为什么也算不对?
晚安,(281181175) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:外围原子的价层电子数怎么算 管理员回复: 外围原子的价层电
nini妮妮(291504216) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:三氟化硼为什么算的不对,求小编指点 管理员回复: http://www
nini妮妮(291504216) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:三氟化硼为什么算的不对
nini妮妮(291504216) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:三氟化硼为什么算的不对
。(873803348) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:总结得很完整 hkh留
hh(2308897252) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:非常感谢
1454602995(1454602995) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:太棒了!!
薄眠DAYTOY(1454600995) 评论 href="/plus/view.php?aid=16772">如何判断分子或离子:太棒了!!
