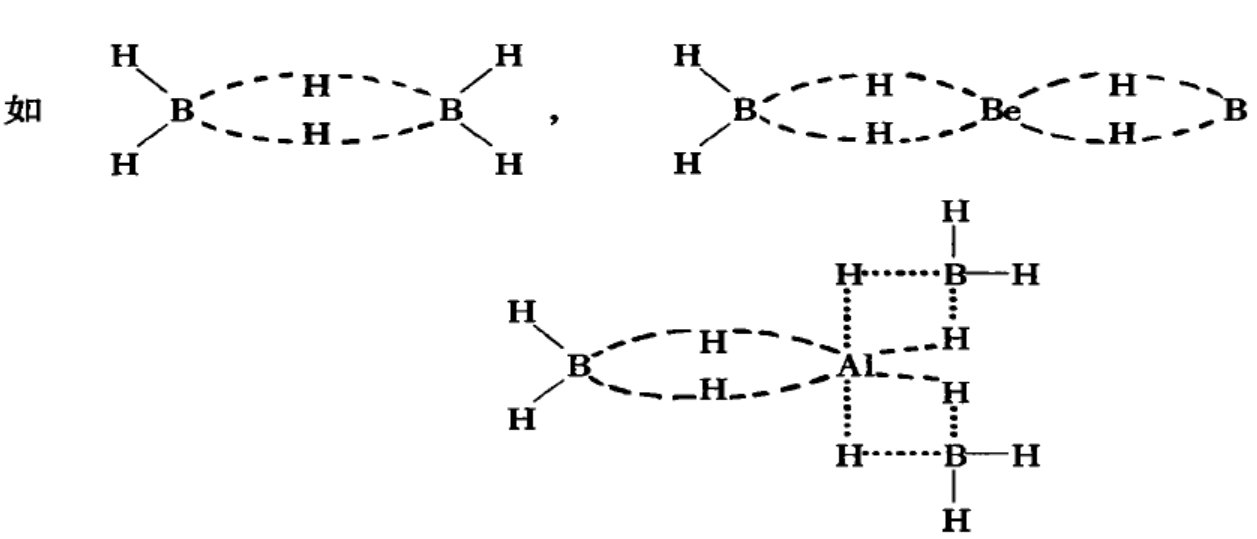
氢键、氢桥键、氢配位键的关系
时间:2019-05-29 15:39 来源:未知 作者:化学自习室 点击:次 所属专题: 氢桥键 氢键02 配位键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、氢键、氢桥键、氢配位键三者的实质是氢键
1、氢键、氢桥键、氢配位键的提出背景、形成条件及其特征
氢键:解决无机氢酸沸点反常性时提出的。该理论认为:氢键的形成须具备两个条件,与氢相联的原子的电负性要大,原子半径要小,氢键具有饱和性和方向性。
氢桥键:解决B2H6结构时提出的。该理论指出,形成氢桥键须具备以下两个条件:①其它原子电负性较氢小;②该原子为缺电子原子,同时指出,氢桥键具有饱和性和一定的方向性。
氢配位键:在解决NH4+中四个N— H键键能、键角、键长都相等这种现象时提出的。该理论指出:能形成氢配位键的元素,须具备两个条件:电负性要大;原子半径要小.同时指出,氢配位键具有饱和性和方向性。
2、氢键、氢桥键、氢配位键作用的基本形式是氢桥
氢键:H─A+ H─B= H─A … H─B
例 H─F+ H─F=… H─F …H─F …
氢桥键:X… H… Y
氢配位键:资料表明,在水溶液中几乎不存在游离氢离子,酸的电离及酸碱中和可表示如下:
X─H+ B→B… H… X→HB+ X.
例 H2O+ HCl= H2O… HCl = H3O++ Cl-,
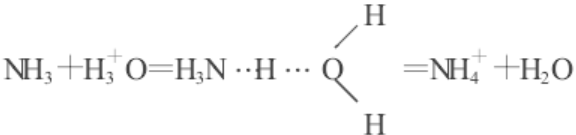
由上知,在形成氢键、氢桥键、氢配位键的形成过程中都出现过氢桥,所以氢桥是三者作用的基本形式。
3、氢键、氢桥键、氢配位键的实质是氢键
3.1 氢键和氢配位键是氢键作用的两种结果
由氢键和氢配位键理论,我们得出它们有如下共同点:
(1)形成要求条件相同:都要求与氢成键的原子电负性大、半径小,且都须为“裸氢”提供孤电子对.
(2)它们都具有饱和性和方向性.
(3)在水溶液中,由于质子通过氢键传递而使H+的迁移速率显得很大这一事实说明,氢键和氢配位键可以互相转化而不会引起体系性质的变化,进而说明了氢键和氢配位键是一种类型的键———氢键作用的两种结果,中间状态和极限结果。
3.2 氢桥键是另一类型的氢键 对比氢键和氢桥键理论,它们有如下共同点:
(1)都必须有富电子基团存在。氢键富电子基是电负性较大且有孤对电子对的元素原子;氢桥键富电子基为带负电荷的氢。
(2)都有缺电子基团.对于氢键,缺电子基团是与电负性较大的元素原子相连的氢;对于氢桥键,缺电子基团是与电负性较大的氢原子相连的其它元素原子。
(3)形成氢键、氢桥键的氢都有一定程度的饱和性和方向性.
(4)从作用结果上看:氢键、氢桥键都能使键长加长,键能削弱.
(5)另有资料表明,在KHF2中氢氟关系可表示为:F… H… F,键长、键能都平均相等而不同于正常的H— F键,所以可以认该分子是氢桥键与氢键相交叉的一个典型例子.
(6)还有资料表明,有弯曲型氢键存在,也有不等臂的氢桥键存在.
综上,氢键、氢桥键、氢配位键实质都是氢键作用的不同结果,所不同的只是在氢键、氢配位键中氢为缺电子基,形成的是正常氢键,而在氢桥键中氢为富电子基,形成的是另一类氢键———负氢键.
二、形成氢键、氢桥键、氢配位键的原因
形成氢键、氢桥键、氢配位键不同结果的原因在于基团对“桥氢”作用力不同
氢桥形成后,由于中心原子对“桥氢”引力不同,“桥氢”总是靠近作用力大的一边,直至“桥氢”脱离一基团而与另一基团成键,由于作用情况不同,出现了上述三种结果.
三、桥式形式的应用举例
1、硼烷的不稳定性
在硼烷中由于带负电荷的是氢,它对电子的引力小,所以当它与电负性相近的元素相遇时能提供给它形成氢桥,如果遇到电负性较大的元素时,则氢提供出电子成为正电荷,原分子被破坏,所以硼烷及B3AlH12在水中不稳定.
2、氢键的形成与物质的水溶性的变化
当物质分子与水形成氢桥后,水溶性增大,当物质分子内形成氢桥后水溶性减小.
3、对烯烃不稳定性的解释
资料表明,物质分子中能形成存在稳定的三电子键.所以,对烯烃我们可以假设形成过程
如下:
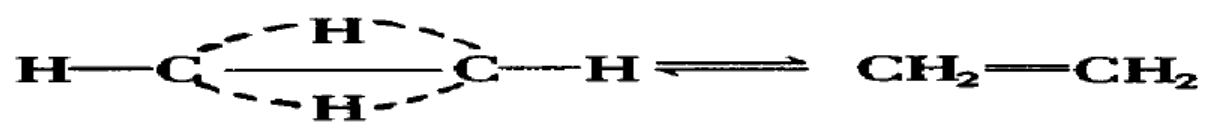
由于存在着弯曲的氢桥键,易受外界干扰遭到破坏,所以烯烃都具有不稳定性.
4、对苯环的解释
在苯环中氢以“桥氢”的形式存在,所以具有“桥氢”的一些性质,但苯环中“桥氢”相间出现与苯环平面的上下易发生共振,“桥氢”所连的原子时刻发生变化,所以宏观上表现为键能、键长平均化,化学性质较烯烃稳定.
5、对CH2═C═ CH2的解释


- 全部评论(0)
