配制一定物质的量浓度稀硫酸溶液
时间:2019-05-30 21:49 来源:未知 作者:骆传汉 点击: 次 所属专题: 浓度配制
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.计算:c(浓硫酸)=1000ρω/M=18.4mol/L
2.量取:用量筒量取5.4ml的浓度硫酸-------仪器为量筒、胶头滴管.
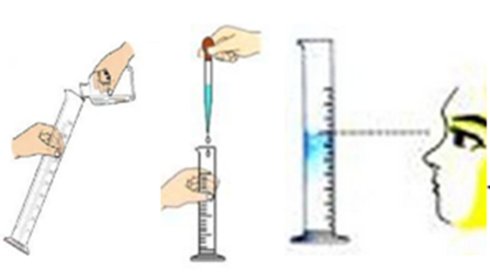
取5.4mL浓硫酸时,量筒的使用要点:“一倒二滴三读数"
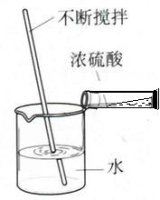
3、在烧杯先放入一定量的水,缓慢倒入浓硫酸,并用玻璃棒搅拌后冷却。
5.定容:加水到接近刻度2-3厘米时,改用胶头滴管加蒸馏水到刻度定容.此时要注意溶液凹液面的最低处和刻度线相切,眼睛视线与刻度线呈水平,不能俯视或仰视,否则都会造成误差

6.摇匀:定容后的溶液浓度不均匀,要把容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,上下颠倒,反复摇匀。
7.把配制好的溶液倒入试剂瓶中,盖上瓶塞,贴上标签.
下面用图片看浓硫酸配制稀溶液的操作过程:

(责任编辑:)

说点什么吧
- 全部评论(0)
(3014753351) 评论 href="/plus/view.php?aid=17337">配制一定物质的量浓:为什么量筒不用清洗?
(3014753351) 评论 href="/plus/view.php?aid=17337">配制一定物质的量浓:为什么量筒不用清洗?
还没有评论,快来抢沙发吧!
