中和滴定的迁移与应用
时间:2020-01-31 14:49 来源:未知 作者:化学自习室 点击: 次 所属专题: 滴定法
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
中和滴定的拓展应用是近几年高考试题的创新题型,主要类型有沉淀滴定和氧化还原滴定。考查角度主要有:①滴定管的使用问题、②滴定指示剂的选择、③滴定终点的现象判断、④定量计算问题、⑤滴定误差分析。
1、沉淀滴定法
(1)概念:沉淀滴定法是利用沉淀反应进行滴定、测量分析的方法。生成沉淀的反应很多,但符合条件的却很少,实际上应用最多的是银量法,即利用Ag+与卤素离子的反应来测定Cl-、Br-、I-浓度。
(2)原理:沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂与被滴定物反应的生成物的溶解度要比滴定剂与指示剂反应的生成物的溶解度小,否则不能用这种指示剂。如用AgNO3溶液滴定溶液中Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更难溶。
2、氧化还原滴定法
(1)原理:以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质,或者间接滴定一些本身并没有还原性或氧化性,但能与某些还原剂或氧化剂反应的物质。
(2)试剂:常见的用于滴定的氧化剂有KMnO4、K2Cr2O7等。常见的用于滴定的还原剂有亚铁盐、草酸、维生素C等。
(3)指示剂:氧化还原滴定法的指示剂有三类:①氧化还原指示剂。②专用指示剂,如在碘量法滴定中,可溶性淀粉溶液遇碘标准溶液变蓝。③自身指示剂,如高锰酸钾标准溶液滴定草酸时,滴定终点现象为溶液由无色变为浅红色。
(4)实例
①酸性KMnO4溶液滴定H2C2O4溶液
原理:2MnO+6H++5H2C2O4===10CO2↑+2Mn2++8H2O。
指示剂:酸性KMnO4溶液本身呈紫红色,不用另外选择指示剂,当滴入最后一滴酸性KMnO4溶液,溶液由无色变为浅红色,且半分钟内不褪色,说明到达滴定终点。
②Na2S2O3溶液滴定碘液
原理:2Na2S2O3+I2===Na2S4O6+2NaI。
指示剂:用淀粉作指示剂,当滴入最后一滴Na2S2O3溶液,溶液的蓝色褪去,且半分钟内不恢复原色,说明到达滴定终点。
3、专题训练
1.(1)莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进而测定溶液中Cl-的浓度。已知:
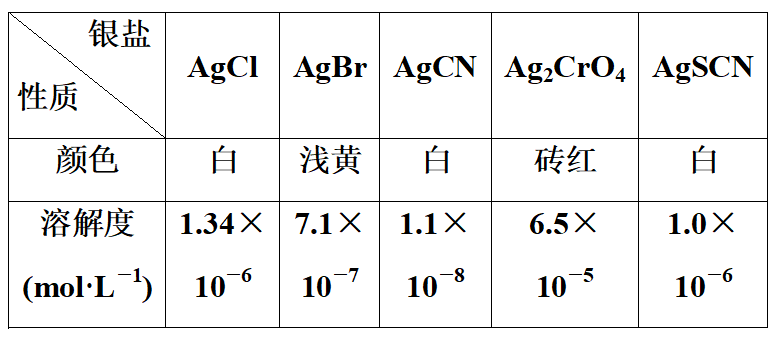
滴定终点的现象是_________________________________________________。
(2)若用AgNO3溶液滴定NaSCN溶液,可选为滴定指示剂的是________。
A.NaCl B.NaBr C.Na2CrO4
刚好达到滴定终点时,发生反应的离子方程式为________________________________________________。
解析:(1)根据沉淀滴定法的原理,可知溶液中Ag+先和Cl-反应,Cl-消耗完后Ag+再和指示剂反应生成Ag2CrO4砖红色沉淀,由此可知滴定终点时的颜色变化。
(2)当用AgNO3溶液滴定NaSCN溶液时,所选择的指示剂和Ag+反应所生成沉淀的溶解度应大于AgSCN的溶解度,由题给数据可以看出溶解度比AgSCN大的有AgCl和Ag2CrO4,但是由于AgCl是白色沉淀,所以应选择Na2CrO4为指示剂,这样在滴定终点时沉淀的颜色发生明显的变化(白色→砖红色)以指示滴定刚好达到终点,此时的离子反应方程式为2Ag++CrO42-===Ag2CrO4↓。
答案:(1)滴入最后一滴标准溶液,生成砖红色沉淀,且半分钟内砖红色沉淀不消失
(2)C 2Ag++CrO42-=Ag2CrO4↓
2.硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应:
C6H8O6+I2===C6H6O6+2H++2I-
2S2O32-+I2===S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1 Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是________mol。

3.氧化还原滴定实验同中和滴定类似。现用0.01 mol/L 酸性KMnO4溶液滴定未知浓度的无色Na2SO3溶液,反应的离子方程式为2MnO4-+5SO32-+6H+===2Mn2++5SO42-+3H2O。
回答下列问题:
(1)该滴定实验中使用的仪器除铁架台、滴定管夹、烧杯外,还需用下列中的________(填序号)。
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶 E.胶头滴管 F.漏斗
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因:_____________。
(3)选何种指示剂,并说明理由:_____________。
(4)滴定前平视KMnO4溶液的液面,刻度为a mL,滴定后俯视液面,刻度为b mL,则(b-a) mL 比实际消耗KMnO4 溶液体积________(填“偏多”或“偏少”)。根据(b-a) mL 计算,得到的待测液浓度比实际浓度________(填“偏大”或“偏小”)。
解析:因酸性KMnO4溶液具有强氧化性,能氧化橡胶,因此盛放酸性KMnO4溶液应用酸式滴定管,Na2SO3溶液呈碱性,应用碱式滴定管量取,除此之外,还需用锥形瓶。因恰好反应时KMnO4溶液紫红色褪去,故不需指示剂。若滴定前平视,滴定后俯视,则(b-a) mL 比实际消耗KMnO4溶液体积偏少,从而测得Na2SO3的浓度偏小。
(3)根据得失电子守恒原理有关系式:5(H2C2O4·2H2O)~2KMnO4,则KMnO4溶液的浓度为
c(KMnO4)=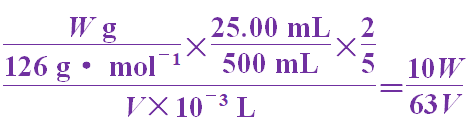 mol·L-1。
mol·L-1。
(4)在放置过程中,由于空气中还原性物质的作用,使KMnO4 溶液的浓度变小了,再去滴定水样中的Fe2+时,消耗KMnO4溶液(标准溶液)的体积会增大,导致计算出来c(Fe2+)会增大,测定的结果偏高。
答案:(1)酸式滴定管 (2)a (3)![]() (4)偏高
(4)偏高

- 全部评论(0)
