怎样准确判断化学平衡移动的方向
时间:2020-02-23 11:27 来源:未知 作者:化学自习室 点击: 次 所属专题: 平衡移动
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
方法有两种:(1)勒夏特列原理(定性的)(2)化学平衡常数法(定量的)
一、勒夏特列原理:
改变影响平衡的一个因素,平衡就向能够减弱这种改变的方向移动
两层意思:(1)平衡移动方向:与改变条件相反的方向(2)平衡移动程度:不能抵消这种改变。
例 1、在一个体积不变的密闭容器中 aA(g)+bB(g) cC(g)+dD(g)反应达到化学平衡状态,再加入一定量的A,判断(1)平衡移动方向?(2)达到新的平衡后,c(A)、c(B)、c(C)、c(D),A、B转化率和体积分数如何变化?
cC(g)+dD(g)反应达到化学平衡状态,再加入一定量的A,判断(1)平衡移动方向?(2)达到新的平衡后,c(A)、c(B)、c(C)、c(D),A、B转化率和体积分数如何变化?
依据勒夏特列原理,再加 A,A与 B将更多反应生成C和D,v(正)>v(逆),平衡向右移动,c(B)会减少,c(C)、c(D)会增大,但是c(A)还是增大,理由是平衡移动不能抵消加入的 A。因此,达到新的平衡后,A的体积分数增大,B的体积分数减小了。转化率则反之。
例2、在温度 t时,在体积为 1L的密闭容器中,使 1molPCl5(g)发生分解:1mol PCl5(g)  PCl3(g) + Cl2(g),当反应达到平衡后,再加入 1moLPCl5(g),化学平衡如何移动?
PCl3(g) + Cl2(g),当反应达到平衡后,再加入 1moLPCl5(g),化学平衡如何移动?
有两种解释,一是从浓度增大,二是从压强增大。从而得出相反的结论。
原因是“改变条件”认识不准确。当 T、V一定时,n(PCl5)增大,则P(PCl5)增大,从而引起P总增大,但此时不能理解为“增大压强”对平衡的影响。因为勒夏特列原理中,“改变压强”指的是:各组分的分压同时增大或减少(容器体积增大或缩小,同等比例增大或减小各气体组分的物质的量)相同倍数而引起体系总压改变,此时,才能认为“是改变压强”,而不能认为总压发生改变就是“改变压强”对平衡的影响。所以此题浓度解释是正确的。
例3、一定温度下,有下列可逆反应2NO2  N2O4,在体积不变的密闭容器中NO2与 N2O4气体达到化学平衡状态。如果向密闭容器中再加入NO2气体,判断:
N2O4,在体积不变的密闭容器中NO2与 N2O4气体达到化学平衡状态。如果向密闭容器中再加入NO2气体,判断:
(1)平衡移动方向?
(2)达到新的平衡后 NO2的体积分数与原平衡相比增大还是减小?
(3)如果改为加入N2O4呢?
例4、在装有可移动活塞的容器中进行如下反应:N2(g)+3H2(g)  2NH3(g),反应达到平衡后,保持容器内温度和压强不变。通入一定氮气,试判断平衡向哪个方向移动?
2NH3(g),反应达到平衡后,保持容器内温度和压强不变。通入一定氮气,试判断平衡向哪个方向移动?
此题变化的条件不是“一个”而是“多个”。若认为改变条件只是通入一定量氮气后,氮气浓度增大,则根据勒夏特列原理平衡应该正向移动,就会得出不准确的答案。因为,充入氮气为了保持压强不变,容器体积会增大,则氢气和氨气浓度均减少,所以改变的条件为“多个”。此时,利用勒夏特列原理不一定能做出正确判断。上述平衡可能正向移动、逆向移动或不移动。
二、平衡常数法
上题,充入氮气后,氮气浓度增大,则氢气和氨气浓度减小,且减小倍数相同,设c'( N2)=m c(N2), c'( H2)=n c( H2), c'( NH3)=n c( NH3) ,m>1,n<1
则:Qc=1/mnK;mn>1平衡正向移动;mn<1逆向移动;mn=1不移动
练习:1某恒温密闭容器中,可逆反应A(s) B( ?)+C(g) ΔH>0达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是( AB)
B( ?)+C(g) ΔH>0达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是( AB)
A.产物 B的状态只能为固态或液态
B.平衡时,单位时间内 n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和 1molC,达到平衡时放出热量 Q
练习:2某温度下,在一容积可变的密闭容器中进行反应,反应达到平衡时,2X(g)+Y(g) 2R(g),反应达到平衡时,X、Y和R分别为 4mol,2mol,4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移是(C)
2R(g),反应达到平衡时,X、Y和R分别为 4mol,2mol,4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移是(C)
A.均减半
B.均加倍
C.均增加1mol.
D.均减少1 mol.
解析:由题知,该反应是在恒温恒压条件下,只要X、Y和 R的物质的量之比符合4 : 2 : 4,都处于平衡状态。 A均减半体积会相应减半,既浓度不变,故平衡不移动
B均加倍,体积会相应加倍,既浓度不变,故平衡不移动
C均增加 1mol.,即 X.Y.R分别为5mol、3mol、5 mol与平衡不移动:X.Y.R分别为5mol、2.5mol、5mol相比,相当于增加0.5molY,则平衡右移。
D均减少1mol,即 X.Y.R分别为 3mol. 1mol. 3mol.与平衡不移动:X.Y.R分别为 3 mol. 1.5 mol. 3 mol相比相当于减少0.5 molY.,则平衡左移。
练习:
3.某温度下,在容积固定的密闭容器中进行反应:2x(g)+Y(g) ![]() 2R(g),反应达到平衡时,X、Y和 R的量分别为4 mol.,2 mol.和 4 mol.,保持温度和容积不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是()
2R(g),反应达到平衡时,X、Y和 R的量分别为4 mol.,2 mol.和 4 mol.,保持温度和容积不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是()
A均减半 B均加倍 C均增加 1mol. D均减少1mol.
解析:本题容器体积固定,可根据浓度商 Q与平衡常数 K的大小关系判断平衡移动方向
设容器体积为 V,则该温度下的平衡常数为:
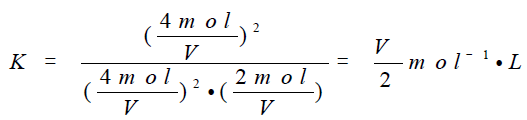
A中均减半,则浓度商:
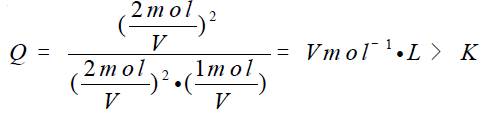
则平衡向左移动
B中均加倍,则浓度商:
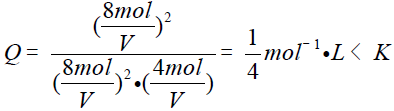
则平衡向右移动
C中均增加1,则浓度商:
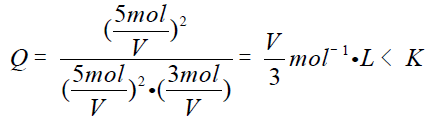
则平衡向右移动
D中均减少 1 mol.,则浓度商:
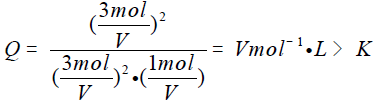
则平衡向左移动
答案选BC
练习:
4.某温度下,在一容积固定的密闭容器中进行反应: 2x(g)+Y(g)  2R(g) 反应达到平衡时,X.Y和 R分别为4 mol, 2mol和 4mol,保持温度和容积不变,按2:1:2向该密闭容器中充入X、Y和R三种气体,则平衡移动方向为()
2R(g) 反应达到平衡时,X.Y和 R分别为4 mol, 2mol和 4mol,保持温度和容积不变,按2:1:2向该密闭容器中充入X、Y和R三种气体,则平衡移动方向为()
A.不移动
B.向左移动
C.向右移动
D.无法确定
【解析】保持温度和体积不变,向另一密闭容器中充入 X.Y和 R分别为 4 mol.,2mol.和4 mol.,则平衡不移动。然后再将这两个容器合并,即合并后的容器体积是原容器体积的两倍,由于各物质浓度不变,故平衡不移动。然后将容器体积压缩为原容器体积,即相当于增大压强,平衡将向着气体体积减小的方向移动,即反应向右移动。
答案选 C
练习:
5、高炉炼铁的总反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g),请回答下列问题:
2Fe(s)+3CO2(g),请回答下列问题:
(2)一定温度下,上述反应的化学平衡常数为3.0,该温度下将 4molCO、2molFe2O3、6mol CO2、5molFe加入容积为2L的密闭容器中,此时反应将向 反应方向进行(填“正”或“逆”或“处于平衡状态”)。
【解析】(2)温度不变,该反应化学平衡常数[K=c 3(CO2)/c3(CO)]不变;起始时c3(CO2)/c3(CO)=(6/2) 3/(4/2) 3=27/8>K=3.0,则此时反应必须向逆反应方向进行,使生成物浓度减小、反应物浓度增大,c 3(CO2)/c3(CO)的比值才能减小为3.0,才能达到该温度下的化学平衡;
练习:6、在一定温度条件下,对于已达到平衡的可逆反应: FeCl3+3KSCN  3KCl+Fe(SCN)3,在此溶液中作如下处理,化学平衡逆向移动的是( )
3KCl+Fe(SCN)3,在此溶液中作如下处理,化学平衡逆向移动的是( )
A.加入少量的 KCl固体
B.加入少量FeCl3固体
C.减少Fe(SCN)3的浓度
D.加水稀释
【答案】D
【解析】该反应的本质是 Fe3++3SCN- Fe(SCN)3,任意时刻的浓度商为
Fe(SCN)3,任意时刻的浓度商为
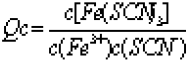 。
。
因为 KCl没有参加反应,因此改变 KCl的量不会影响到平衡的移动,故 A项错误;加入少量FeCl3固体或减少Fe(SCN)3的浓度,均会使Qc<K,平衡正向移动,故B、C均错误;加水稀释,使c(Fe3+)、c(SCN-)和c(Fe(SCN)3)的浓度均减小,但c(Fe3+)×c(SCN-)减小的更快,使 Qc>K,平衡逆向移动,故D正确。

- 全部评论(0)
(2380387350) 评论 href="/plus/view.php?aid=18110">怎样准确判断化学平:感谢您的文档,真的很好用,总结的非常好
(1214150499) 评论 href="/plus/view.php?aid=18110">怎样准确判断化学平:所以说,勒夏特列原理只能解释单一条件的变化,如果多个条件
(1214150499) 评论 href="/plus/view.php?aid=18110">怎样准确判断化学平:所以说,勒夏特列原理只能解释单一条件的变化,如果多个条件
