原电池教学中疑难问题探讨
时间:2021-12-27 19:22 来源:未知 作者:蔡惠君 点击: 次 所属专题: 原电池工作原理
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、图1中锌片上的电子为什么会流向铜片?
以图1为例,其中Zn、Cu两极、电解质(硫酸铜溶液)构成内电路,连接在Zn、Cu两极板上的导线和电流表等负载构成外电路。从外电路看,Zn失电子,电子通过导线转移到Cu,所以,把Zn极叫负极,Cu极叫正极。从内电路看,由于Zn失电子,被氧化,与电解池的阳极一样,Cu2+得电子,被还原,与电解池的阴极一样,为了和电解统一,内电路里,把Zn极又叫阳极,Cu极又叫阴极。在考查中,不要求学生判断原电池内电路的阴阳极。
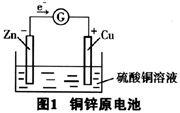
用导线将图1原电池的两个电极连接起来,其间有电流通过。这表明两个电极之间存在电位差。下面简单介绍金属及其盐溶液之间相界面上电位差是怎样产生的。
金属晶体是由金属原子、金属离子和自由电子组成的。当把金属插入其盐溶液中时,表面的金属离子与溶液中极性水分子相互吸引而发生水化作用。这种水化作用可使表面上部分金属离子进入溶液而把电子留在金属表面上,这是金属溶解过程。金属越活泼,溶液越稀,金属溶解的倾向越大。另一方面,溶液中的金属离子有可能碰撞金属表面,从金属表面上得到电子,还原为金属原子沉积在金属表面上。这个过程为金属离子的沉积。金属越不活泼,溶液浓度越大,金属离子沉积的倾向越大。当金属的溶解速度和金属离子的沉积速度相等时,达到了动态平衡。
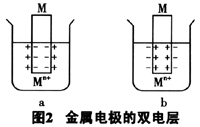
在一给定浓度的溶液中,若金属失去电子的溶解速度大于金属离子得到电子的沉积速度,达到平衡时,金属带负电,溶液带正电。溶液中的金属离子并不是均匀分布的,由于静电吸引,较多地集中在金属表面附近的液层中。这样在金属和溶液的界面上形成了双电层(见图2-A),产生电位差。反之,如果金属离子的沉积速度大于金属的溶解速度,达到平衡时,金属带正电,溶液带负电。金属和溶液的界面上也形成双电层(图2-B),产生电位差。

金属与溶液间电位差的大小,取决于金属性质和溶液中离子的浓度等。金属越活泼,电位越低;金属越不活泼,电位越高。增大溶液浓度,金属离子得电子,还原为金属原子沉积在金属表面上,会导致电极上的负电荷减少,电位升高,即金属离子浓度越大,电位越高,金属离子浓度越小,电位越低。图1原电池装置中,由于金属锌失去电子的趋势比铜大,所以锌片上有过剩的电子,而铜片上有过剩的正电荷,若用导线把锌片和铜片连接起来,电子就从锌片流向铜片,由于锌片上的电子流出,锌片上的负电荷减少,从而和溶液中的Zn2+离子间的平衡被破坏,Zn2+离子就可以不断地进入溶液;与此同时,流到铜片上的电子,就可以与溶液中的Cu2+离子结合生成金属铜,并在铜片上沉积下来。这样电子不断地从锌片流向铜片,从而产生电流。
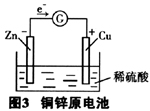
二、图3中的锌铜原电池,为什么放电效率低?
图3中的锌铜原电池开始工作时,Zn片上没有气泡,但不久后,Zn片上慢慢产生少量的气泡,用灵敏检流计检测,电流微弱,供电时间短暂,不能持续对外提供电能,电池的放电效率低,因此不适合于实际应用。
这是什么原因呢?该锌铜原电池反应开始后,铜极上很快就聚集了许多氢气泡,把铜极跟稀硫酸逐渐隔开,增加了电池的内阻,电极出现极化现象,这种极化作用会阻碍H+在Cu片上继续得电子,Zn片上的电子也就不能顺畅地输送到Cu片上,使电流不能畅通,有些H+就直接在Zn片上夺取电子生成H2。
三、干电池中的二氧化锰是正极材料还是电解质?
干电池中的二氧化锰既不是正极材料也不是电解质,而是一种去极化剂。
干电池中的碳棒作正极,负极是锌筒,电解质是氯化铵、氯化锌的水溶液。干电池工作时,锌和氯化铵发生变化,产生氢气,附着在碳棒上面。由于氢气的电阻很大,电池工作时,在电极附近产生相当大的电压降,使路端电压降低,产生极化作用,所以,要在干电池中加入二氧化锰作为“去极化剂”,吸收正极放出的H2,防止产生极化现象。有关反应为: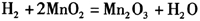
四、减小极化作用的途径
无论何种材料制作的原电池,只要有电流通过,就有极化作用存在。
图3铜锌原电池工作的过程中,Zn极(负极)金属溶解后,电极附近的Zn2+浓度增大,从而减缓负极金属的溶解速率;铜电极析出的氢气吸附于其上,阻扰氢离子的得电子速率,电极被极化。极化作用会使负极电势升高、正极电势降低,电极的放电反应变得迟钝,影响电池的工作时间。如何减小图3铜锌原电池的极化作用?
要减小极化作用,可采取的措施:
(1)铜锌原电池工作时,不断振动铜片除去其表面上的气泡。(2)加入去极化剂。
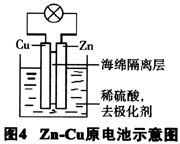
在原电池反应中加入强氧化剂,如高锰酸钾,重铬酸钾等,见图4,它可以使Zn电极部分形成一层氧化膜,从而大大改善Zn电极金属的溶解速率,这些强氧化剂还能把正极产生的氢气氧化生成水,使两电极的极化作用均得以减缓。
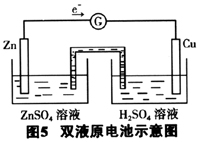
五、图5双液原电池中,电解质溶液如何选择?
图5双液原电池的特点:Cu片(正极)上电解质溶液参加了反应,Zn片(负极)附近的电解质溶液不参加反应,它只起到导电的作用。故正极电解质溶液的选择要看电极反应,应选择所含离子参与正极反应的电解质溶液,负极电解质溶液一般选择与电极材料相同的金属阳离子的溶液,也可以是比负极金属活泼的金属阳离子的溶液。如图5的双液原电池,正极电解质溶液可以是稀硫酸或盐酸,负极是锌,电解质溶液可以是硫酸锌、硝酸锌或氯化锌等,也可以是NACl等不与锌反应的电解质溶液,但不能是硫酸铜等。

- 全部评论(0)
