多硫化物、硫代硫酸钠、连二亚硫酸钠性质总结
时间:2024-09-18 11:57 来源:未知 作者:化学自习室 点击: 次 所属专题: 硫的含氧酸盐
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
随着化工产业的进步,在纺织和印染方面出现了许多高效的硫的化合物,其中一些是非常重要的还原剂,在染料合成、造纸和医学部门等发挥着重要的作用。
一、多硫化物
1.多硫化物的生成:
Na2S或(NH4)2S的溶液能够溶解单质硫,就好像碘化钾溶液可以溶解单质碘一样,在溶液中生成多硫化物:
Na2S+(x-1)S=Na2Sx(NH4)2S+(x-1)S=(NH4)2Sx
多硫化物溶液一般显黄色,其颜色可随着溶解的硫的增多而加深,最深为红色。
多硫化钠Na2S2是常用的分析化学试剂,在制革工业中用作原皮的脱毛剂;多硫化钙CaS4
在农业上用作杀虫剂。
2.多硫离子的结构:
多硫离子具有链状结构,S原子通过共用电子对相连成硫链。例如多硫离子S32-、S42-、S62-的结构。

3.多硫化物的氧化性:
当多硫化物M2Sx中的x=2时,例如Na2S2或(NH4)2S2,可以叫做过硫化物,过硫化物实际是过氧化物的同类化合物。
(1)多硫化物在酸性溶液中很不稳定,容易歧化分解生成H2S和单质S:
(2)多硫化物是一种硫化试剂,在反应中它向其它反应物提供活性硫而表现出氧化性。例如:
SnS+(NH4)2S2= (NH4)2SnS3
As2S3+3Na2S2=2Na3AsS4+S
多硫化物能将Sns硫化亚锡(II)氧化成硫代锡(IV)酸盐(NH4)2SnS3而溶解。将三硫化二砷(III)As2S3氧化成硫代砷(IV)酸盐而溶解。
二、硫代硫酸钠:
硫代硫酸H2S2O3非常不稳定,但硫代硫酸盐是相当稳定的。
市售硫代硫酸钠Na2S2O3·5H2O俗名海波或大苏打,是一种无色透明的晶体,易溶于水,其水溶液显弱碱性。Na2S2O3在中性或碱性溶液中很稳定,在酸性(pH≤4.6)溶液中迅速分解:
Na2S2O3+2HCl =2NaCl+S+H2O+SO2↑
这个反应可以用来鉴定S2O32-离子的存在。在制备Na2S2O3时,溶液必须控制在碱性范围内,否则将会有硫析出而使产品变黄。
1.其结构特点:

S2O32-离子的结构与SO42-类似,具有四面体构型。S2O32-可以看成是SO42-中的一个O原子被S取代后的产物。
S2O32-离子中的两个S原子的平均氧化数是+2,中心S原子的氧化数为+6,另一个S原子的氧化数为-2。因此,Na2S2O3具有一定的还原性。
2.还原性:
从标准电极电势值看,Na2S2O3是一个中等强度的还原剂:
I.碘可以将Na2S2O3氧化成连四硫酸钠Na2S4O6:2Na2S2O3+I2=Na2S4O6+2NaI这个反应是容量分析碘量法的基础。
II.较强的氧化剂如氯、溴等可以把Na2S2O3氧化成硫酸钠,因此在纺织和造纸工业上用Na2S2O3作脱氯剂:
Na2S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl
3.配合性:
不溶于水的卤化银AgX(X=Cl、Br、I)能溶解在Na2S2O3溶液中生成稳定的硫代硫酸银配离子;Na2S2O3用作定影液,就是利用这个反应溶去胶片上未感光的AgBr。
4.特征反应
Na2S2O3溶于水,但重金属的硫代硫酸盐难溶于水并且不太稳定。例如:
但Ag2S2O3沉淀很快变黑,这是因为S2O32-中的S2-与Ag+生成了溶度积更小的Ag2S沉淀而使Ag2S2O3沉淀转化。
5.制备方法
I.在沸腾的温度下使亚硫酸钠Na2S2O3溶液与S粉反应:Na2SO3+S=Na2S2O3II.将Na2S和Na2CO3配成2:1的溶液,然后通入SO2气体:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
在制备Na2S2O3时,溶液必须控制在碱性范围内,否则将会有S析出而使产品变黄。
三、过二硫酸及其盐:
过二硫酸可以看成是过氧化氢H-O-O-H中H原子被亚硫酸氢根HSO3-取代的产物。若H-O-O-H中一个H被HSO3-取代后得H-O-O-SO3H,即称为过一硫酸;另一个H也被取代后得HsO3-O-O-SO3H,称为过二硫酸。
1.它的结构式:

过氧键-O-O-中O原子的氧化数为-1,而不同于其它的O原子,其中S原子的氧化数仍然是+6。而在H2S2O8分子式中,形式上S的氧化数为+7。过二硫酸是无色晶体,338K时熔化并分解。
2.过二硫酸及其盐的强氧化性:
所有的过二硫酸及其盐都是强氧化剂。
例如:过二硫酸钾能把铜氧化成硫酸铜:K2S2O8+Cu =CuSO4+K2SO4
过二硫酸盐在Ag+的催化作用下能将Mn2+氧化成紫红色的MnO4-:
2Mn2++5S2O82-+8H2O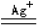 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
如果没有Ag+作催化剂,S2O82-只能把Mn2+氧化成MnO(OH)2的棕色沉淀。
在钢铁分析中,常用过二硫酸铵(或过二硫酸钾)氧化法测定钢中锰的含量。
过二硫酸及其盐作为氧化剂在氧化还原反应过程中,它的过氧链断裂,过氧链中两个O原子的氧化数从-1降到-2,而S的氧化数不变,仍是+6。
3.过二硫酸及其盐的热不稳定性:
过二硫酸及其盐均不稳定,加热时容易分解,例如K2S2O8受热会放出SO3和O2:
2K2S2O8 2K2SO4+2SO3+O2
2K2SO4+2SO3+O2
4.过二硫酸及其盐的制备方法:
工业上在电解法制备过氧化氢的过程中就可以得到过二硫酸或过二硫酸盐。
电解硫酸或硫酸氢铵溶液,在阳极(铂极)上SO42-或HSO4-被氧化生成S2O82-,在阴极上(石墨或铅极)产生H2气。
四、连二亚硫酸钠:

连二亚硫酸钠Na2S2O4在工业上称作保险粉,是一种白色粉末状固体。
X光衍射分析表明,在Na2S2O4中的S2O42-离子是由两个SO2-原子团通过S-S键(键长为239pm)结合而成的。其中S的氧化数为+3。
1.连二亚硫酸钠的强还原性
Na2S2O4在碱性介质中是一强还原剂:
它的水溶液在空气中放置,就能被空气中的氧氧化,生成亚硫酸盐或硫酸盐。
2Na2S2O4+O2+2H2O=4NaHSO3
Na2S2O4+O2+H2O=NaHSO3+NaHSO4
因此,Na2S2O4在气体分析中用来吸收氧气,它还是印染工业中非常重要的还原剂,许多有机染料都能被它还原。它广泛用于染料合成、造纸、保存食物和医学等部门。
2.连二亚硫酸钠的不稳定性
Na2S2O4加热到402K时即分解:
2Na2S2O4=Na2S2O3+Na2SO3+SO2↑
在水溶液中极不稳定,容易歧化分解:由硫的不同氧化态的吉布斯自由能图也可以看出这一点。连二亚硫酸位于亚硫酸和硫代硫酸连线的上方,因此溶液中它不稳定易歧化。
3.连二亚硫酸钠的制备方法
在没有氧的条件下,用Zn粉还原NaHSO3,或用钠汞齐与干燥的SO2作用,可以得到Na2S2O4:
2NaHSO3+Zn=Na2S2O4+Zn(OH)2
2Na[Hg]+2SO2=Na2S2O4+2Hg

- 全部评论(0)
