铜及其化合物性质归纳
时间:2016-01-18 21:59 来源: 作者:李文才 点击: 次 所属专题: 铜及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
铜及其化合物的性质虽然在中学化学中没有专门介绍,但他们的性质散在中学教材的各个章节中,尤其在近几年高考题、竞赛题中经常出现铜及其化合物的影子,便于同学们掌握它们的性质,现归纳如下:. 铜
1.结构:原子序数29,位于周期表中第四周期、第IB族,最外层有1E,常有![]() 价。
价。
2.物理性质:纯铜呈暗红色,属有色金属,导电导热性,延展性良好,焰色反应呈绿色。
3.化学性质:
一、铜是一种较不活泼的金属,位于金属活动性顺序表中氢原子之后。
(1)与![]() 的反应
的反应
在空气中或![]() 中加热表面变黑:
中加热表面变黑:![]() ,利用此反应可除去混在氢气、一氧化碳中的少量
,利用此反应可除去混在氢气、一氧化碳中的少量![]() ,在高温下还可生成
,在高温下还可生成![]() 。
。
(2)与![]() 的作用
的作用
在潮湿的空气中铜可生成铜绿,![]() 。
。
(3)与其他非金属的反应,Cu在![]() 中燃烧生成棕黄色烟:
中燃烧生成棕黄色烟:![]() ;
;
在硫蒸气里燃烧生成黑色固体:![]()
(4)与酸的反应
<1>与稀盐酸、稀![]() 溶液不反应;
溶液不反应;
<2>与浓![]() 反应:
反应:![]()
<3>与硝酸反应:
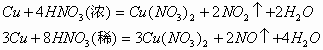
(5)与盐溶液反应:
![]()
![]() (印刷电路板反应原理)
(印刷电路板反应原理)
(6)作催化剂:铜能催化醇氧化为醛或酮的反应,如
![]()
实质分两步
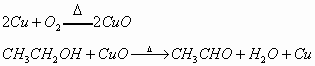
总反应:![]() .
.
二、铜的化合物
1.氧化物
CuO是不溶于水的碱性氧化物,具有较强氧化性,在加热时能被CO、![]() 、C等还原:
、C等还原:
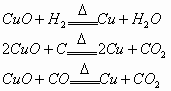
可与酸反应:
![]()
![]() 呈砖红色,可用于制红色玻璃,
呈砖红色,可用于制红色玻璃,![]() 本身较稳定,但在酸液中易发生歧化反应生成Cu和
本身较稳定,但在酸液中易发生歧化反应生成Cu和![]() 。
。
2.![]()
(1)难溶性碱,可与酸反应:
![]()
(2)受热易分解
![]()
(3)有弱氧化性,新制的![]() 能氧化醛基化合物,本身被还原为
能氧化醛基化合物,本身被还原为![]() ,常用于醛基化合物的检验:
,常用于醛基化合物的检验:
![]()
制备:可溶性![]() 盐与强碱反应:
盐与强碱反应:
![]() (蓝色絮状沉淀)
(蓝色絮状沉淀)
3.铜盐
常见的铜盐有![]() 等。
等。
(1)颜色:无水![]() 呈棕黄色,
呈棕黄色,![]() 晶体呈蓝色,其浓溶液呈绿色,无水硫酸铜呈白色,
晶体呈蓝色,其浓溶液呈绿色,无水硫酸铜呈白色,![]() 及溶液呈蓝色。常用无水硫酸铜白色粉末检验水蒸气或水的存在。
及溶液呈蓝色。常用无水硫酸铜白色粉末检验水蒸气或水的存在。
(2)化学性质
<1>水解性:其水溶液显弱酸性:![]()
<2>氧化性:与金属单质反应:![]()
<3>与强碱反应:![]() (用于实验室制备氢氧化铜)
(用于实验室制备氢氧化铜)
<4>胆矾受热可失去结晶水变成白色粉末,过热时,![]() 会进一步分解出CuO。
会进一步分解出CuO。
<5>可溶性铜盐能与![]() 或
或![]() 反应生成黑色的CuS沉淀,它难溶于强酸,常用于
反应生成黑色的CuS沉淀,它难溶于强酸,常用于![]() 的检验。
的检验。
<6>![]() 易与
易与![]() 形成
形成![]() 络离子。
络离子。
<7>铜盐的电解:

<8>铜的精炼:以粗铜为阳极、纯铜为阴极、![]() 溶液为电解液进行电解,可将粗铜提纯。
溶液为电解液进行电解,可将粗铜提纯。

- 全部评论(0)
