范围计算和关系计算题的解题方法
时间:2016-01-09 21:21 来源: 作者:张楠 点击: 次 所属专题: 讨论法 计算方法
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
范围计算题或关系计算题是由讨论计算题衍变出的新题型。这种题型的答案不是一个数值,而是一个取值范围,或两个量的关系。它往往要求分几种情况考虑,这些情况不是要求去讨论,而是题中已指出,只要求答者按所指的情况去确定其结果。掌握某些知识的一般规律和公式,对解答这种题型很有帮助。例如,天平平衡计算问题的三种一般情况,铝盐溶液与强碱溶液反应,偏铝酸盐溶液与强酸溶液反应,Ca(OH)2、NaOH溶液与CO2反应的几种情况和公式,等等。该题属于此种题型,对于像本题一样的连续反应,要求取值范围或两个量之间的关系,则应抓住每个转折方程式的完全反应为中心加以判定。
1.将mmol的Na2O2和nmol的NaHCO3固体混合物在密闭容器中加热至250℃,让其充分反应后排出气体。
(1) 分析当m与n按不同的比值进行反应时,容器内固体成分与排出气体成分的5种情况填写下表中的空格。(设只有当CO2与Na2O2反应完后,H2O才能与Na2O2反应)
序号 | | 固体物质的成分 | 排出气体物质的成分 |
① | < | ||
② | Na2CO3 | O2、H2O | |
③ | | ||
④ | =1 | ||
⑤ | Na2CO3、NaOH、Na2O2 | O2 |
(2) 当排出气体只含H2O(g)和O2两种成分且物质的量相等时,则原固体混合物中Na2O2和NaHCO3的物质的量之比为___________。
解析:(1) 此题实质上是分析发生的连续反应的分段情况。
2NaHCO3![]() Na2CO3+H2O-+CO2 ①
Na2CO3+H2O-+CO2 ①
2Na2O2+2CO2=2Na2CO3+O2 ②
2Na2O2+2H2O=4NaOH+O2 ③
当发生反应①、②且完全反应时,则有Na2CO3、H2O和O2,![]() ,即
,即![]() =
=![]() ;若Na2O2不足,则CO2有剩余,则
;若Na2O2不足,则CO2有剩余,则![]() <
<![]() 。
。
当发生反应①、②、③且完全反应时,m=n,![]() =1,有Na2CO3、NaOH和O2;若Na2O2不足以与水完全反应,则水蒸气有剩余,
=1,有Na2CO3、NaOH和O2;若Na2O2不足以与水完全反应,则水蒸气有剩余,![]() <1;若Na2O2有剩余,则
<1;若Na2O2有剩余,则![]() >1。
>1。
(2) 设反应的水的物质的量为x,
2NaHCO3![]() Na2CO3+H2O-+CO2- ①
Na2CO3+H2O-+CO2- ①
n ![]()
![]()
![]()
2Na2O2+2CO2=2Na2CO3+O2 ②
![]()
![]()
![]()
![]()
2Na2O2+2H2O=4NaOH+O2- ③
x x ![]()
由题意得![]() -x=
-x=![]() +
+![]() ,x=
,x=![]() ;m=
;m=![]() +x=
+x=![]() ,
,![]() =
=![]() =
=![]() 。
。
答案:(1) ①Na2CO3;O2、H2O、CO2 ②=![]() ③Na2CO3、NaOH;O2、H2O ④Na2CO3、NaOH;O2 ⑤>1 (2) 2∶3
③Na2CO3、NaOH;O2、H2O ④Na2CO3、NaOH;O2 ⑤>1 (2) 2∶3
2.将Na2O2与NaHCO3固体混合物置于密闭容器中加热充分反应,放出气体后冷却,可能发生的反应有:
2Na2O2+2NaHCO3![]() 2Na2CO3+2NaOH+O2↑
2Na2CO3+2NaOH+O2↑
2Na2O2+4NaHCO3![]() 4Na2CO3+2H2O↑+O2↑
4Na2CO3+2H2O↑+O2↑
2NaHCO3![]() Na2CO3+2CO2↑+O2↑
Na2CO3+2CO2↑+O2↑
(1) 若原固体混合物的质量为Wg,反应后冷却再称量其质量减少DWg,设NaHCO3、Na2O2的物质的量分别为amol、bmol。试确定在下述各种条件下DW的取值范围。(用含的代表式表示)。
当![]() ≤1时,DW的取值范围是_______________________;
≤1时,DW的取值范围是_______________________;
当1<![]() ≤2时,DW的取值范围是_______________________;
≤2时,DW的取值范围是_______________________;
当![]() >2时,DW的取值范围是_______________________。
>2时,DW的取值范围是_______________________。
(2) 若W =14.52 g,DW=1.28 g,向反应后残留固体中滴加2.00 mol / L的盐酸140.0 mL时,还能放出多少升气体(标准状况下的体积)?
解:(1) DW≤![]() ;
; ![]() <DW≤
<DW≤![]() ;
; ![]() <DW≤
<DW≤![]()
(2) 由![]() <
<![]() 知,
知,![]() <1,发生第一个反应,加热时只放出O2。
<1,发生第一个反应,加热时只放出O2。
放出O2的量:![]() =0.0400 mol
=0.0400 mol
2Na2O2+2NaHCO3![]() 2Na2CO3+2NaOH+O2↑
2Na2CO3+2NaOH+O2↑
0.0800 0.0800 0.0800 0.0400
反应后剩余Na2O2:14.52 g-(78.0 g / mol+84 g / mol)×0.0800 mol =1.56 g,
n(Na2O2) =![]() =0.0200 mol,
=0.0200 mol,
2Na2O2+2H2O =4NaOH+O2↑
0.0200 0.0400 0.0100
NaOH + HCl = NaCl + H2O
0.0800+0.0400 0.1200
Na2CO3消耗的盐酸为:2.00 mol / L×0.140 L-0.1200 mol =0.1600 mol,
Na2CO3+2HCl =2NaCl+H2O+CO2↑
0.1600 0.0800
放出气体的总体积为:(0.0100 mol+0.0800 mol)×22.4 mol / L =2.02 L。
3.在已平衡的托盘天平左右托盘上各放一只等质量的烧杯,并分别往烧杯中注入5 mol / L盐酸60 mL。向左盘烧杯中放入ag CaCO3粉末,往右盘烧杯中加入xg A物质的粉末,充分反应后天平仍保持平衡。
(1) 若A为NaHCO3,
①当a≤15时,x的值为_______;(用含a的代数式表示,以下同)
②当18.6 ≥a>15时,x的值为_________;
③当a>18.6时,x的值为__________。
(2) 若A为KHCO3,且两只烧杯中均无固态物质存在,则x的取值必须满足的条件是________。
解析:0.15 mol CaCO3恰好与0.3 mol HCl反应完全。
(1) ①由于CaCO3可小于0.15 mol,可认为CaCO3与NaHCO3均反应完全,盐酸过量。设的质量为x g。
CaCO3+2HCl =CaCl2+H2O+CO2↑
![]()
![]()
NaHCO3+2HCl =2NaCl+H2O+CO2↑
![]()
![]()
![]() (100-44) =
(100-44) =![]() (84-44),
(84-44), ![]() ×56 =
×56 =![]() ×40
×40
x=1.176 a
②CaCO3过量,以盐酸计算CO2;NaHCO3完全反应,以NaHCO3计算CO2。
a-0.15 mol×44 g / mol =![]() ×40 g / mol, 2.1a-6.6×2.1 =x x=2.1a-13.86
×40 g / mol, 2.1a-6.6×2.1 =x x=2.1a-13.86
③CaCO3与NaHCO3过量,以盐酸计算CO2,
a-0.15 mol×44 g / mol =x-0.3 mol×44 g / mol x=a+6.6
(2) 因CaCO3与KHCO3相对分子质量皆为100 g,要使二者完全反应,均应等于或小于15 g。即 x=a≤15。
注意:要产生相同量的CO2,CaCO3消耗多;要消耗相同量的HCl,NaHCO3消耗量多。
4.在天平的两个托盘上各放一个盛有等体积、等物质的量浓度的稀硫酸的烧杯,调节天平使其平衡。然后在一个烧杯中加入ag铁粉,在另一个烧杯中加入bg镁粉,充分反应后,天平仍保持平衡。若已知每个烧杯中都含有mmol H2SO4,试用代数式表示下列各种情况下a和b的关系。
(1) 当![]() >m,
>m,![]() >m时:________________________;
>m时:________________________;
(2) 当![]() <m,
<m,![]() <m时:________________________;
<m时:________________________;
(3) 当![]() <m,
<m,![]() >m时:________________________;
>m时:________________________;
解析:(1) 当![]() >m,
>m,![]() >m时,金属过量,酸完全反应,由于
>m时,金属过量,酸完全反应,由于![]() >
>![]() ,故应 a = b=
,故应 a = b= ![]() ×m×2 = 56m (2) 当
×m×2 = 56m (2) 当![]() <m,
<m,![]() <m时,酸过量,金属完全反应,
<m时,酸过量,金属完全反应,![]() (3) 当
(3) 当![]() <m,
<m,![]() >m时,Mg过量,Fe完全反应,b-2m= (56-2)×n(Fe) =54×
>m时,Mg过量,Fe完全反应,b-2m= (56-2)×n(Fe) =54×![]() =
= ![]() 。
。
答案:(1)a=b (2) ![]() 或81a=77b (3)
或81a=77b (3) ![]()
5.电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。有关反应为:2FeCl3+Cu=2FeCl2+CuCl2。
现将一块敷有铜箔的绝缘板浸入8.00×102mL某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉mg,充分反应后剩余固体ng。将固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00 mL,向其中滴入3.00 mol / L AgNO3溶液60.00 mL时,溶液中的Cl-恰好完全沉淀。请计算:
(1)溶液A中FeCl3的物质的量浓度为 ;
(2)假若铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于 ;
(3)讨论当剩余固体的组成不同时,m与n可能的取值范围,并填入下表。
剩余固体的组成 | m的取值范围 | n的取值范围 |
只有铜 | ||
有铁且有铜 | (用含m的代数式表示) |
(4)当m=100.0,n=96.8时,溶液B中FeCl2的物质的量浓度为 mol / L。
解析:(1)3.00 mol / L
提示:根据FeCl3~ 3AgCl ~ 3AgNO3
n(FeCl3)=![]() ×3.00 mol / L×0.060 L×
×3.00 mol / L×0.060 L×![]() =2.40 mol,C(FeCl3)=
=2.40 mol,C(FeCl3)=![]() =3.00 mol / L
=3.00 mol / L
(2)67.2 g
提示:当铁粉不再溶解时,铜全部析出,溶液中无Fe3+
根据2FeCl3~ Fe (溶解的铁)
n(Fe)=![]() ×3.00 mol / L×0.080 L=1.20 mol,m(Fe)=1.20 mol×56 g / mol=67.2 g
×3.00 mol / L×0.080 L=1.20 mol,m(Fe)=1.20 mol×56 g / mol=67.2 g
(3)
剩余固体的组成 | m的取值范围 | n的取值范围 |
只有铜 | 0<m≤67.2 | 0<n≤76.8 |
有铁且有铜 | m>67.2 | m-67.2<n≤m+9.6 |
提示:76.8-67.2=9.6
2FeCl3+Cu=2FeCl2+CuCl2
2.4 1.2
CuCl2+Fe =FeCl2+Cu Dm
1.2 1.2(67.2) 1.2 ®76.8 9.6
如果溶液中还有FeCl3,剩余固体量至少为m-67.2;如果溶液中全是CuCl2,剩余固体量至多为m+9.6。
(4)2.5 mol / L
提示:m=100.0>67.2,可知铁过量,铜全部析出。
剩余固体m(Fe)=100.0 g-67.2 g=32.8 g
n(Cu)=![]() =1.00 mol/L
=1.00 mol/L
由2FeCl3+Cu=2FeCl2+CuCl2,
n(FeCl2)=2×1.00 mol/L=2.00 mol/L
c(FeCl2)=![]() =2.50 mol/L
=2.50 mol/L
6.取ag NaHCO3和Na2O2的固体混合物,在密闭容器中加热到250℃,经充分反应后排出气体,冷却后称得固体质量为bg。
(1)为快速求出原混合物的成分,应根据加热前后固体的质量判定出加热后固体的成分,判定方法是 。
(2)填写下列表格:
序号 | 1 | 2 | 3 | 4 | 5 |
b、a质量比 (用m表示) | m= | m=1 | |||
加热后固体成分 (分子式) | Na2CO3 | Na2CO3 | Na2CO3 Na2O2 | Na2O2 |
(3)若b、a之比为0.95,求原混合物里Na2O2的质量分数。
解析:(1)用a、b的质量比判定剩余固体成分,从而列式计算。
(2)
序号 | 1 | 2 | 3 | 4 | 5 |
b、a质量比 (用m表示) |
| m= |
| ||
加热后固体成分 (分子式) | Na2CO3 |
(3)73.75%
解析:按转折方程式考虑:
①2NaHCO3=Na2CO3+H2O-+CO2-
84 53
②4NaHCO3+2Na2O2=Na2CO3+H2O-+O2-
84 39 106
123
③2NaHCO3+2Na2O2=2Na2CO3+2NaOH+O2-
84 78 106 40
162/81 146/73
2NaHCO3+2Na2O2=2Na2CO3+2NaOH+O2-
![]()
![]() =
=![]() , (因b=0.95 a)
, (因b=0.95 a)
m(NaHCO3)=![]() mol×84 g / mol=0.2625 a,m(Na2O2)=a-0.2625 a=0.7375 a, (Na2O2)%=73.75%
mol×84 g / mol=0.2625 a,m(Na2O2)=a-0.2625 a=0.7375 a, (Na2O2)%=73.75%
7.已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2;②Br2能将I-氧化为I2;③KIO3能将I-氧化为I2,也能将Br-氧化Br2,其本身被还原为I2。
现向含有1 mol KI的硫酸溶液中加入含amol KBrO3的溶液。a的取值不同,所得产物也不同。
(1)试将讨论的结果填入表中
编号 | a的取值范围 | 产物的化学式(或离子符号) |
① | I2、Br- | |
② |
| |
③ | I2、 | |
④ |
(2)此表编号③中当n(I2)=n(![]() )时,a的值为 。
)时,a的值为 。
解析:有关的已知条件是:
①KBrO3+KI®KIO3+Br2,KBrO3+KI®I2+Br2,②Br2+KI®KBr+I2,③KIO3+KI®I2,KIO3+KBr®I2+Br2,
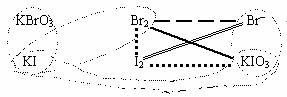
找出①和④的化学方程式是关键。
①2KBrO3+12KI+6H2SO4=2KBr+6I2+6K2SO4+6H2O
④6KBrO3+5KI+3H2SO4=5KIO3+3Br2+3K2SO4+3H2O
(2)8KBrO3+15KI+9H2SO4=5KIO3+5I2+9K2SO4+9H2O+4Br2
答案:(1)(见下表) (2)![]()
编号 | a的取值范围 | 产物的化学式(或离子符号) |
① | 0<a≤ | |
② | I2、Br-、Br2 | |
③ |
| |
④ | a≥ |
|
8.常温下,把CH4和O2组成的混合气体共amol通入装有4.68 g Na2O2固体的密闭容器中,用电火花不断引燃,使之在高温下充分反应,恢复到常温时,容器内气体压强几乎为零。
(1)讨论剩余固体的成分与a的取值,CH4和O2的体积比(n)三者的关系,填写下列表格。
a取值 | n= | 剩余固体 |
(2)当剩余固体全部加入足量盐酸中,产生560 mL气体(标准状况),剩余干燥的固体的质量是多少?
解析:抓住两个转折方程式:
① 2CH4+3O2+2Na2O2=2Na2CO3+4H2O
0.15 0.06
②2CH4+O2+6Na2O2=2Na2CO3+8NaOH
0.03 0.06
(2)产生的气体为0.025 mol,
①当剩余固体全为Na2CO3时,应产生0.06 mol气体,不合题意。
②当剩余固体为Na2CO3和NaOH时,n(Na2CO3)=0.025 mol,n(NaOH)=0.12 mol-0.025 mol×2=0.07 mol,剩余固体总质量为:0.025 mol×106 g / mol+0.07 mol×40 g / mol=5.45 g。
③当剩余固体为Na2CO3、NaOH和Na2O2时,采用极限分析法,
6Na2O2![]() 2Na2CO3
2Na2CO3 ![]() 2CO2 (由化学方程式②得出)
2CO2 (由化学方程式②得出)
0.06 0.02 0.02
2Na2O2 ![]() O2
O2
0.06 0.03 (假设固体全部是Na2O2)
由十字交叉法可得出:Na2O2的两种情况的分配是各占一半,即有0.03 mol Na2O2的发生反应,生成0.01 mol的Na2CO3和0.04 mol的NaOH;还有的0.03mol Na2O2未反应。
剩余固体的总质量为:0.01 mol×106 g / mol+0.04 mol×40 g / mol+0.03mol×78 g / mol=1.06 g+1.6 g+2.34 g=5 g。
答案:(1)
a=0.15 | n=2∶3 | Na2CO3 |
0.03≤a<0.5 |
| Na2CO3、NaOH |
a<0.03 | n=2 | Na2CO3、NaOH、Na2O2 |
9.将由amol NaHCO3和bmol NaOH组成的固体混合物放在密闭容器中加热到250℃,经充分反应后,排出气体,冷却后,称量残留固体的质量为wg。试写出由a、b表示的w的表达式。(写出计算过程)
(1) 当a≤b时,w值应为多少?
(2) 当a>b时,w值应为多少?
解析:(1)
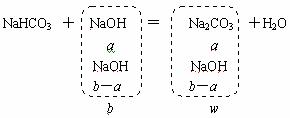
w=106a+(b-a)×40=106a+40b-40a=66a+40b
(2)
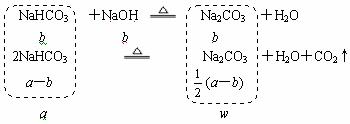
w=106×[b+![]() (a-b) =106b+53a-53b=53(a+b)
(a-b) =106b+53a-53b=53(a+b)

- 全部评论(0)
