有关化学平衡图像识别
时间:2016-02-01 13:10 来源: 作者:龙立球 点击: 次 所属专题: 化学平衡图像
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
对于可逆反应 mA (g) + nB(g)  pC(g) + qD(g) + Q , 有关化学平衡的图象主要有以下几类:
pC(g) + qD(g) + Q , 有关化学平衡的图象主要有以下几类:
一.“温度 ~ 速率曲线”(T ~ v 曲线):
这类曲线一般只有以下四种图象形式 :
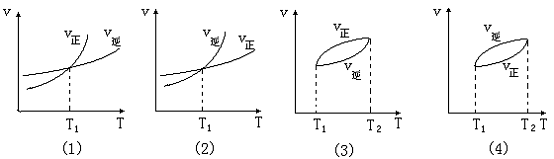
图象(1):随着温度升高,v正、v逆都增大;在温度为T1时,v正=v逆,反应达到平衡状态;当温度高于T1时,v正、v逆继续增大,且增大值Δv正>Δv逆,平衡向正反应方向移动,正反应为吸热反应,反应热Q<0.
图象(2):随着温度升高,v正、v逆都增大;在温度为T1时,v正=v逆,反应达到平衡状态;当温度高于T1时,v正、v逆继续增大,且增大值Δv正<Δv逆,平衡向逆反应方向移动,正反应为放热反应,反应热Q>0.
图象(3):T1时,反应达到平衡;升高温度,v正、v逆都增大,平衡向正反应方向移动,在T2点时,建立起新的平衡,反应热Q<0。
图象(4):T1时,反应达到平衡;升高温度,v正、v逆都增大,平衡向逆反应方向移动,在T2点时,建立起新的平衡,反应热Q>0。
二.“压强 ~ 速率曲线”(P ~ v 曲线):
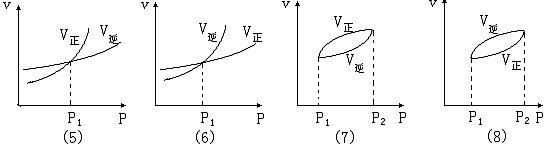
图象(5):随着压强增大,v正、v逆都增大;在压强为P1时,v正=v逆,反应达到平衡状态;当压强高于P1时,v正、v逆继续增大,且增大值Δv正>Δv逆,平衡向正反应方向移动,气体分子数减小 , m + n > p + q 。
图象(6):随着压强增大,v正、v逆都增大;在压强为P1时,v正=v逆,反应达到平衡状态;当压强高于P1时,v正、v逆继续增大,且增大值Δv正<Δv逆,平衡向逆反应方向移动,气体分子数减小 , m + n < p + q 。
图象(7):P1时,反应达到平衡;升高压强,v正、v逆都增大,速率增加量Δv正>Δv逆,平衡向正反应方向移动,在T2点时,建立起新的平衡;m + n > p + q 。
图象(8):P1时,反应达到平衡;升高压强,v正、v逆都增大,速率增加量Δv正<Δv逆,平衡向逆反应方向移动,在T2点时,建立起新的平衡;m + n < p + q 。
三.“时间 ~ 速率曲线”(t ~ v 曲线或叫做“过程曲线”):
对于可逆反应 mA (g ) + nB (g) pC (g ) + qD(g ) + Q , 这类图象存在下列几种基本形式:
pC (g ) + qD(g ) + Q , 这类图象存在下列几种基本形式:
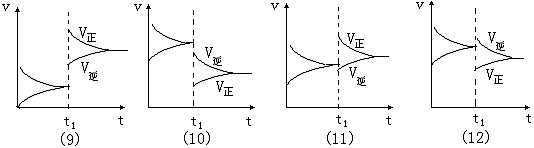
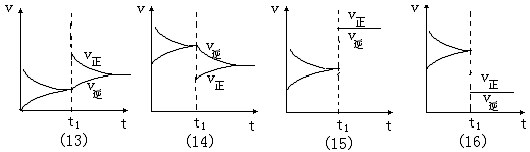
图象(9):t1点时,条件的改变有两种可能:①.升高温度,反应速率增大,速率增量Δv正>Δv逆 , 平衡向正反应方向移动,正反应为吸热反应,反应热Q < 0 ;②.增大压强,反应速率增大,速率增量Δv正>Δv逆 , 平衡向正反应方向移动,气体分子数减小 , m + n > p+q。 图象(10):t1点时,条件的改变有两种可能:①.降低温度,反应速率减小,速率减量Δv正>Δv逆, 平衡向逆反应方向移动,逆反应为吸热反应。反应热Q < 0 ;②.减小压强,反应速率减小,速率减量Δv正>Δv逆 , 平衡向正反应方向移动,气体分子数减小 , m + n > p + q 。
图象(11):t1点时,v正增大,v逆减小,平衡向正反应方向移动,条件的改变是在增大反应物浓度的同时减小生成物浓度。
图象(12):t1点时,v正减小,v逆增大,平衡向逆反应方向移动,条件的改变是在减小反应物浓度的同时增大生成物浓度。
图象(13):t1点时,v正增大,v逆不变,平衡向正反应方向移动,条件的改变是增大反应物浓度。
图象(14):t1点时,v正减小,v逆增大,平衡向逆反应方向移动,条件的改变是增大生成物浓度。
图象(15):t1点时,v正增大,v逆增大,且速率增量Δv正=Δv逆,对应的条件改变有两种可能:①.使用催化剂;②.增大压强,且符合m + n = p + q。
图象(16):t1点时,v正减小,v逆减小,且速率减量Δv正=Δv逆,对应的条件改变只能是减小压强,且符合m + n = p + q 。
四.“时间 ~ 物质含量曲线”(t ~ X%曲线):
1.变温曲线:
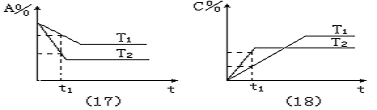
图象(17):t1点时,T2温度下的A%减小值大于T1温度下的A%减小值,所以,温度的高低为T1<T2;两种平衡状态相比较,高温(T2)平衡时A%值较低温(T1)平衡时A%值所减小,平衡向正反应方向移动,正反应为吸热反应,反应热Q<0。
图象(18):t1点时,T2温度下的C%增加值大于T1温度下的C%增加值,所以,温度的高低为T1<T2;两种平衡状态相比较,高温(T2)平衡时C%值较低温(T1)平衡时C%值有所减小,平衡向正反应方向移动,正反应为放热反应,反应热Q>0。
2.变压曲线:
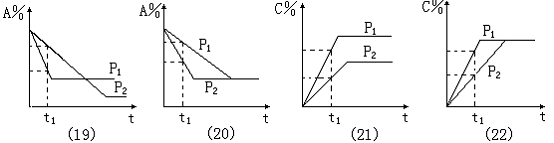
图象(19):t1点时,压强P2时的A%减小值大于压强P1时的A%减小值,所以,压强的大小为P1>P2;对于两种平衡比较,压强增大,A%增大,平衡向逆反应方向移动,m+n<p+q。
图象(20):t1点时,压强P2时的A%减小值大于压强P1时的A%减小值,所以,压强的大小为P1>P2;对于两种平衡比较,压强改变,A%不变,化学平衡不发生移动,m + n = p+q。 图象(21):t1点时,压强P1时的C%增大值大于压强P2时的C%增大值,所以,压强的大小为P1>P2;对于两种平衡比较,压强增大,C%增大,平衡向正反应方向移动,m+n>p+q 。
图象(22):t1点时,压强P2时的C%增大值大于压强P1时的C%增大值,所以,压强的大小为P1>P2;对于两种平衡比较,压强改变,C%不变,化学平衡不发生移动,m+n = p+q 。
3.其它:
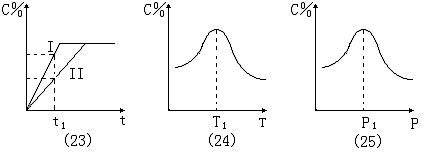
图象(23):t1点时,C%的增加量为状态 I 大于状态 II ;条件改变时 , 平衡不发生移动。所以 , 条件 I 有两种可能:①.使用催化剂。②.增大压强 , 且满足 m + n = p + q 。
图象(24):T1为平衡点 ;T1点以前 , v正 > v逆 , 没有 达到化学平衡状态 , T1点以后 , 随着温度的升高 , C%减小 , 表示化学平衡向逆反应方向移动, 正反应为放热反应, Q>0 。
图象(25):P1为平衡点 ;P1点以前 , v正 > v逆 , 反应没有 达到化学平衡状态 ;P1点以后 , 随着压强的增大 , C%减小 , 表示化学平衡向逆反应方向移动 , 气体分子数减少 , m + n = p + q 。
五.“等压曲线”:
“等压曲线”的图象存在以下几种基本形式:
图象(26):温度一定 (T1 点 ) 时 , P1 线上C%值大于P2 线上C%值 , 压强大小为两种可能:①.P1>P2 ,则增大压强时 , 平衡向正反应方向移动 , m + n > p + q 。②.当P1< P2 时 , 压强增大时 , 平衡向逆反应方向移动 , m + n < p + q 。当压强一定时 , 温度升高 , C%增大 , 平衡向正反应方向移动 , 正反应为吸热反应 , Q<0。
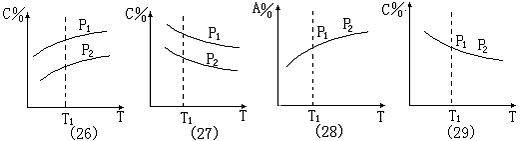
图象(27):当 温度一定(T1 点) 时 , P1 线上C%值大于P2 线上C%值 , 压强大小为两种可能: ①.若P1>P2 , 则增大压强 ,C% 增大 ,平衡向正反应方向移动 , m + n > p + q ;
②.若P1<P2 , 则增大压强 ,C% 减小 ,平衡向逆反应方向移动 , m + n < p + q 。当压强一定时 , 温度升高 , C%减小 , 平衡向逆反应方向移动 , 正反应为放热反应 , Q>0。
图象(28):当 温度一定时 , 改变压强 , 化学平衡不发生移动,m + n = p + q ;当 温度升高时 , C%增大 , 平衡向正反应方向移动 ,Q<0。
图象(29):当 温度一定时 , 改变压强 , 化学平衡不发生移动,m + n = p + q ;当 温度升高时 , C%减小 , 平衡向逆反应方向移动 , Q>0。
六.“等温曲线”:
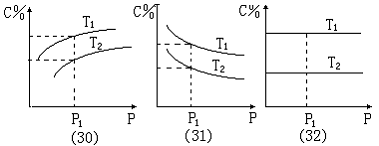
“等温曲线”的图象存在以下几种基本形式:
图象(30):当压强一定 (P1 点)时 , T1 线上C%值大于T2 线上C%值 , 温度的高低有两种可能:①.若 T1>T2 , 则温度升高时 , C%值增大 , 平衡向正反应方向移动,Q<0 。②.若T1< T2 , 则温度升高时 , C%值减小 , 平衡向逆反应方向移动 , Q>0 。当温度一定时 , 随 增大 压强 , C%增大 , 平衡向正反应方向移动 , m + n > p + q 。
图象(31):当压强一定 (P1 点) 时 , T1 线上C%值大于T2 线上C%值 , 温度的高低有两种可能:①.若 T1>T2 , 则温度升高时 , C%值增大 , 平衡向正反应方向移动 , Q<0 。②.若T1< T2 , 则温度升高时 , C%值减小 , 平衡向逆反应方向移动 , Q>0 。当温度一定时 , 随增大 压强 , C% 减小 , 平衡向逆反应方向移动 , m + n < p + q 。
图象(32):当压强一定 (P1 点) 时 , T1 线上C%值大于T2 线上C%值 , 温度的高低有两种可能:①.若 T1>T2 , 则温度升高时 , C%值增大 , 平衡向正反应方向移动 , Q<0 。②.若T1< T2 , 则温度升高时 , C%值减小 , 平衡向逆反应方向移动 , Q>0 。当温度一定时 , 压强 改变 , C% 不变 , 化学平衡不发生移动 , m + n = p + q 。

- 全部评论(0)
