氧化性:氧和氯谁强?
时间:2021-03-02 09:25 来源:未知 作者:化学自习室 点击:次 所属专题: 氧化性 氯气
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
这是一个老生常谈的话题,小编觉得这个问题值得拿来讲的原因有几个:
1、题目中出现O2、Cl2的频率高
2、O、Cl元素的电负性和单质的氧化性不一致
一、电负性比较
选修三P19电负性数据为:O为3.5,Cl为3.0,因此氧原子的氧化性大于氯原子是毋庸置疑的
二、单质的氧化性比较
O元素的单质有O2、O3,其中O2又有三线态和单线态之分
Cl元素的单质只有Cl2
这里主要比较Cl2和最常见的三线态O2的氧化性
1、从结构上比较
O2的是O=O双键,键能为497.3 kJ∙mol-1;
Cl2的是Cl-Cl单键,键能为198 kJ∙mol-1。
双键键能大,使得O2比较稳定,降低了O2的氧化性;
单键键能小,使得Cl2依然比较活泼。
2、从电极电势数据比较
电极过程 | E/V | ||
O2 | 酸性条件 | O2+4H++ 4e-═2H2O | + 1.229 |
碱性条件 | O2+2H2O+ 4e-═4OH- | +0.401 | |
Cl2(酸碱性数值一样) | Cl2+2e-═2Cl- | + 1.358 | |
注:电极电势数据使用说明:数值越正,代表氧化性越强;数值越负,代表还原性越强。
电极电势适用条件:水溶液体系,一定温度范围。非水溶液、高温情况均不适用!
从上面数据可以看出是氯气氧化性大于氧气
3、从高中已知的例子比较
Cl2可以直接把Fe2+氧化为Fe3+,而O2氧化它的速率慢的多;
Cl2通入水中,会很缓慢的释放出O2
4、从电解氯化钠溶液这个事实比较
2Cl-+ 2H2O ==H2↑+ Cl2↑+2OH-
既然氯气氧化性强,按理说应该先生成O2才对,但是实际上是先生成Cl2,又如何解释?
如果只是看理论分解电压,确实应该先生成O2,但是实际上有个叫做“超电势”的东西存在,使生成O2的分解电压要比生成Cl2的大得多
下面是来源于傅献彩《物理化学》第五版下册P124的数据
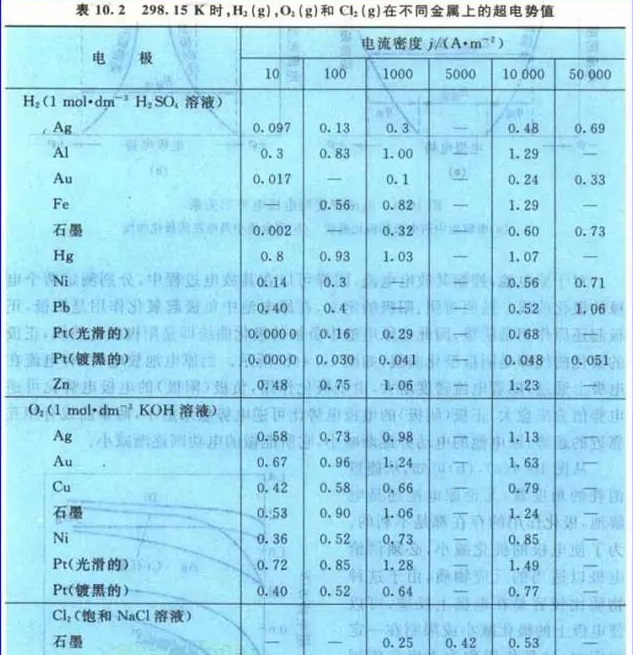
结论:氧化性:O >Cl;O2< Cl2。

- 全部评论(0)
