非金属氢化物的酸性变化规律
时间:2022-03-25 10:24 来源:未知 作者:化学自习室 点击:次 所属专题: 酸性 氢化物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
以酸碱电离理论的角度看,大多数非金属氢化物溶于水并且显酸性,例如 HCl,也有显碱性的,例如 NH3,但是像 CH4 不溶于水,SiH4 水解。
放宽眼界,以酸碱质子理论的角度不再局限于水溶液中,能解离出质子的都是酸,所以非金属氢化物都可以看做是酸,强弱不同的酸,无论是否溶解于水溶液中。
那么,酸的强弱就跟解离出质子的难易相关,容易解离氢质子的酸性强,难易解离质子的酸性弱。
解离氢质子的难易又是由谁来决定的?
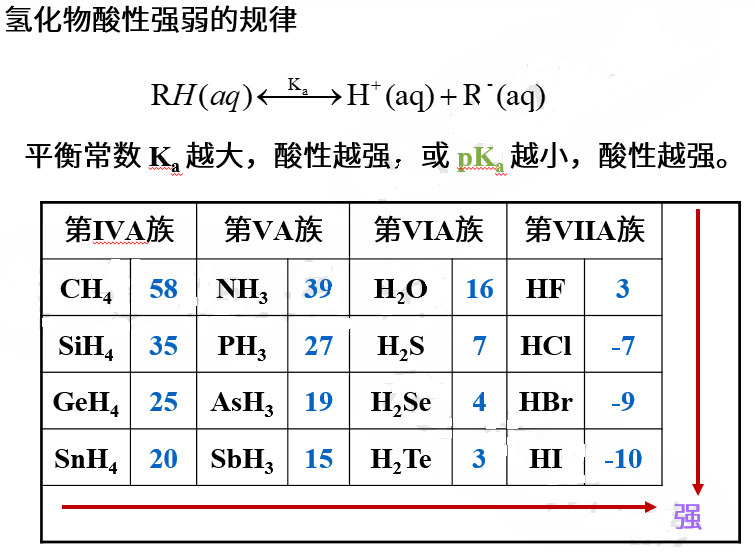
非金属氢化物是非金属原子和氢原子以共价键结合的分子型氢化物,把与氢原子直接键合的非金属原子看做中心原子,中心原子周围电子密度大的话束缚氢质子的能力就强,氢质子难失去,酸性弱。电子密度则取决于中心原子的电荷数和半径大小,例如电负性最大、半径最小的氟的氢化物HF是弱酸,而电负性稍小的氯的氢化物 HCl 是强酸。
1、结构相同的卤素氢化物,中心原子电荷数均为 -1、同一族从上到下半径逐渐增大,酸性从F到I逐渐增强。
2、同一周期,从左向右,非金属氢化物的中心原子电负性逐渐增强,半径逐渐减小,电子密度逐渐增大,酸性逐渐增强。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
