中和滴定的拓展和计算
时间:2020-01-31 15:18 来源:未知 作者:童建军 点击:次 所属专题: 滴定法
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
定性检验与定量实验是不同实验方法,定量实验中仪器选 择与数据的采集直接相关,所以实验中要根据实验精度要求选 择好合理的仪器,重点是滴定法(酸碱中和滴定、氧化还原滴 定、沉淀溶解滴定)、物质纯度测定(气体法、沉淀法、滴定法、差减法)。同时要关注实验操作、指示剂选择、实验中误差产生原因与分析.实验中做好下列处理才能取得良好的效果.
1、定量测定实验中数据的采集和处理,是实验成败的关键, 所以一定要关注条件、实验数据、仪器的精确度。在选择仪器时,要注意实验精度要求,例如配制溶液时需要称量0.15 g 固体溶 质,选用托盘天平就达不到要求,就要用电子天平;液体试剂的 取用也一样。高中用到的精量仪器在使用中要注意估读,以提 高实验的精确程度,例如滴定管和10 mL 量筒,最小刻度都是 0.1 mL,但滴定管估读一位,精确度就达到0.01 mL。
2、定量测定实验的误差分析是考试的难点,溶液配制、中和滴定、纯度测定、厚度测定中都有一定的误差,学会进行误差分析,提升自己实验能力减少误差是化学科学习的目的。
3、定量测定实验中,某次数据差异太大,要分析原因,重测或舍去此组实验数据。
4、实验是否完成的准确判断,中和滴定中选择不同的指示剂对实验终点判断不一样,选酚酞时溶液中弱碱性时变色,选甲基橙时溶液在弱酸性时变色.某些滴定实验中由于反应过程中的明显的颜色变化,实验中可不用再选择其他指示剂。例如, 用酸性高锰酸钾法进行滴定时不需另加指示剂,因为高锰酸钾 本身就是指示剂,用碘量法进行滴定时,一般用淀粉作为指示 剂,所以要针对具体题目做具体分析。
例:化合物KxFe(C2O4)y • 3H2O(Fe为+3价)是一种光 敏材料,实验室可以用如图1所示的方法来制备这种材料并测 定这种材料的组成。
I.制备
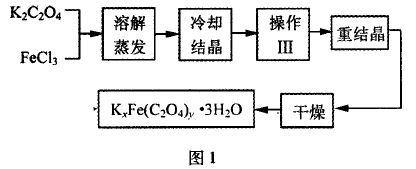
(1)结晶时应将溶液用冰水冷却并在黑暗处等待晶体的析出,这样操作的原因是:________
(2)操作Ⅲ的名称是_______ :_________
Ⅱ.组成测定
称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀 H2SO4,将C2O42-转化为 H2C2O4后用 0. 1000 mol· L-1 KMnO4溶液滴定,当消耗KMnO4溶液24. 00mL 时恰好完全反 应;再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为 Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4 溶液4.00 mL.相关反应的化学方程式和离子方程式如下:
2 KMnO4 +5H2C2O4 +3H2SO4 =2MnSO4 + K2SO4 + 10CO2 +8H2O
MnO4-+5Fe2++8H+ =Mn2++5Fe3++4H2O
(3) 配制100mL0. 1000 mol . L-1 KMnO4溶液及滴定实验 中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有_____ (填仪器名称)。两个滴定中,终点时溶液颜色为_______ 色,且30 S内不变色。
(4) 该化合物尺KxFe(C2O4)y • 3H2O中,x=
解析:(1)用冰水冷却有利玉析出更多的晶体,由于化合物KFe(C2O4)y • 3H2O(Fe为+3价)是一种光敏材料,在黑暗中操作可以防止晶体分解。
(2) 分析流程图1,操作Ⅲ为过滤、洗涤
(3) 配置一定量物质的量浓度溶液时,需要的玻璃仪器有: 烧杯、玻璃棒、胶头滴管、100 mL 容量瓶、量筒;滴定实验中所需 的玻璃仪器有:锥形瓶、酸式滴定管等.在上述实验步骤中,滴定 终点时溶液颜色变为红色。
(4) 由反应关系式得出:
2KMnO4 + 5H2C2O4 + 3H2SO4 =2MnSO4+10CO2+8H2O
2 5
0.1000 mol •L-1 ×24mL ×10-3 6×10-3
MnO4- + 5Fe2++8H+=Mn2++5Fe3++4H2O
1 5
0.1000mol.L-1 ×4ml×10-3 2×10-3
由此得出,化合物KxFe(C2O4)y • 3H2O中,n(Fe):n(C2O42-) =1:3,根据化合价代数和为0,得出x=3。
答案:(1)用冰水冷却有利于析出更多的晶体,黑暗可以防止晶体分解;(2)过滤、洗涤;(3)100 mL 容量瓶、酸式滴定管 (紫)红;(4)3
点评:本题考查了化学实验原理、基本操作以及各种操作和 实验现象的分析以及化学计算.这类题目,要注意分析实验的实 验目的、步骤、仪器使用等,结合实验问题进行原理的分析与问 题的解答,其中常见基本实验操作为考查重点。
特别提醒:使用滴定管时要注意:
①要根据所要量取的液体 性质选择合适的滴定管,如溶液呈酸性或强氧化性时,选用酸式滴定管;溶液呈碱性时,选用碱式滴定管;溶液呈中性时,二者均 可选用。
②要根据所需溶液的体积选择合适的规格的滴定管, 常用滴定管的规格有25 mL和50 mL等。
③使用前要检查是否 漏水并洗净,在装溶液前要用待装溶液润洗2 ~3次,避免因滴 定管内壁附有少量蒸馏水稀释而导致溶液浓度减小。
④装好溶 液,在读数前赶走滴定管尖嘴内的气泡,并调整液面到“0”刻度 或“0”刻度以下。
⑤读数时要使眼睛与液面保持平行,读取与凹 液面相切处的数据。
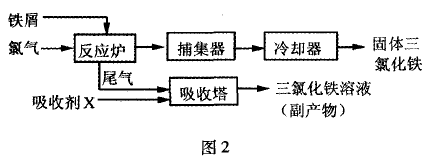
踉踪训练1:氯化铁是常见的水处理剂,无水FECl3的熔点 为555 K、沸点为588 K.工业上制备无水FeCl3的一种工艺如图 2所示。
(1)取0.5mL三氯化铁溶液滴人50 mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为
(2)表1是六水合氯化铁在水中的溶解度。
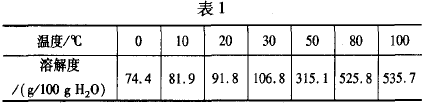
从FeCl3溶液中获得FeCl3 • 6H2O的方法是____
(3)捕集器中温度超过673 K,存在相对分子质量为325的 物质,该物质的分子式:
(4)吸收剂X是 ;吸收塔中吸收剂X的作用是
(5)FeCl3的质量分数通常可用碘量法测定:称取 m g 无水 氣化铁样品,溶于稀盐酸,再转移到100 mL 容量瓶,用蒸馏水定容;取出10.00 mL,加人稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol/L Na2S2O3,溶液滴定(I2 +2S2O32-=2I-+S4O62-),共用去V mL.则样品中氯化铁的质量分数为_______
答案:(l)Fe3++3H2O = Fe(OH)3(胶体)+3H+.
(2)加 人少量盐酸加热浓缩,再冷却结晶
(3)Fe2Cl6
(4)FeCl2溶 液;吸收反应炉中过量的氯气和少量氯化铁烟气
(5) 162.5 Vc/m%
解析:
(1)根据氢氧化铁胶体的制备原理:Fe3++3H2O = Fe(OH)3(胶体)+3H+
(2)由于Fe3+易水解,所以要在实验过程中,加人盐酸加热,抑 制其水解程度.
(3)因为在673 K,溶液中水分蒸发完全,结合 相对分子质量得到物质的分子式为Fe2Cl6.
(4)根据框图流 程分析尾气为Cl2,可以用FeCl2溶液作吸收剂,吸收反应炉中 过量的氣气和少量氯化铁烟气.
(5)根据反应关系式:
Fe3+ ——I- ——S2O32-
162.5 1
x ×10 c mol/L × V mL ×10 -3
x= 162.5 cV×10-2
样品中氯化铁的质量分数为:w(FeCl3) =162.5 Vc/m%
跟踪训练2:奶粉中的含氮有机物(即蛋白质),在浓硫酸和 硫酸铜的作用下可消化生成硫酸铵,如图3流程图,测定出奶粉 中氮元素的含量,再经过计算便可求得奶粉中蛋白质的赓量分数
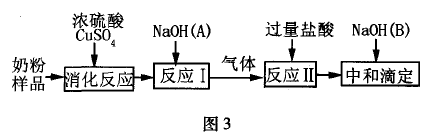
(1)反应I中使用氢氧化钠(A)的目的为
(2)反应II的离子方程式为 .
(3)在中和滴定的过程中:
①碱式滴定管用蒸馏水洗涤后,直接加人NaOH标准溶液进行滴定,则测得样品中氮元素的含量将______ (填选项字母,下同)
(A)偏高(B)偏低(C)无影响
②滴定时边滴边摇动锥形瓶,眼睛应观察()
(A)滴定管内液面的变化
(B)锥形瓶内溶液颜色的变化
③现有3种酸碱指示剂,其pH的变色范围如下:
(A)甲基橙:3.1 ~4.4 (B)石蕊 :5.0~8.0 (C) 酚酞:8.2~10.0
在实验过程中应选择____ 为指示剂.
(4)某小组学生按上述流程进行实验,记录了表2数据:

该奶粉样品中氮元素的质量为_____;该奶粉样品中蛋白质的质量分数为__(已知蛋白质中氮的质量分数约为 16.0)
答案:
(1)与硫酸铵充分反应并使氨气逸出。
(2)NH3 + H+ =NH4+;
(3)①(A)②(B)③(A) (4) 0.014 g 14.6%
解析:
(1)分析框图流程,加人氢氧化钠(A)目的是与硫酸 铵充分反应并使氨逸出,用来测定N的含量;
(2)由反应I产生 的氨与盐酸反应的离子方程式:NH3 +H+ =NH4+
(3)①酸碱滴 定过程中,滴定管使用前需要洗涤和润洗,①中的碱式滴定管没有润洗,直接加人NaOH溶液,使浓度变小,滴定使用的体积变 大,计算结果偏高。②在滴定操作中,眼睛要始终观察锥形瓶内 溶液颜色的变化。③因为中合滴定前的溶液是氯化铵溶液,溶液 显酸性,所以选用甲基橙做指示剂.
(4)由关系式:N—NH3— OH-计算可得:m(N) =0.014 g;蛋白质的质量分数为:x% = 14.6 %

- 全部评论(0)
(1956837721) 评论 中和滴定的拓展和计算:真的很不错
