如何定量判断弱酸与强碱弱酸盐混合后的酸碱性?
时间:2016-04-22 22:53 来源:未知 作者:谢文芳 点击:次 所属专题: 酸碱性
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
等物质的量的CH3COOH与CH3COONa的混合溶液呈酸性,等物质的量的 NH3 • H2O与NH4Cl的混合溶液呈减性,等物质的量的HCN与NaCN的混合溶 液呈碱性。这其中有什么规律?如何判断HA弱酸和相应的NaA以等物质的量混 合后溶液酸碱性?
设某弱酸HA的电离常数为K,与等物质的量的NaA混合后,溶液为中性,则存在如下关系:
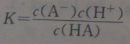 :弱酸的电离平衡
:弱酸的电离平衡
Kw=c(OH-)c(H+):水的电离平衡
c(Na+ ) +c(H+ ) =c(A-)+c(OH-):电荷守恒
2c(Na+)=c(A-)+c(HA): 物料守恒
c(OH-)=c(H+):溶液为中性
当HA和NaA等体积混合时,通过演算得出,当K=10-7时,以上各等式成立, 并可得出如下关系:
①当k=10-7时,溶液显中性,此时,NaA的水解和HA的电离程度相同(实际 情况可能不存在);
②当K>10-7时,溶液显酸性,此时,NaA的水解比HA的电离程度小,如 CH3COONa 和 CH3COOH;
③当K<10-7时,溶液显碱性,此时,NaA的水解比HA的电离程度大,如HCN溶液和 NaCN 溶液。
说明:某一元弱酸与其相应的强碱盐等物质的量混合后,若主观地认为水解作用较弱、以电离为主,则会得出溶液显酸性的结论。若两种溶液并非等量混合,则关于溶液的酸碱性更不能轻易下结论。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
