氧化还原反应五规律
时间:2006-09-07 03:44 来源: 作者:胡中宇 点击:次 所属专题: 氧化还原反应规律
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、表现性质的规律
同种元素具有多种价态时,一般处于最低价时只具有还原性,处于最高价时只具有氧化性,处于中间可变价时既具有氧化性又具有还原性。
例1在下列物质中,既具有氧化性又具有还原性的是 ( )。
A.铁 B.硫 C.铁和硫 D.氧和铁
答案:B。
二、性质强弱的规律
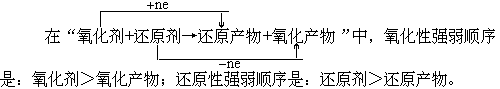
例2(1993年高考题)根据反应式:(1)2Fe3++2I-=2Fe2++I2,(2)Br2+2Fe2+=2Br-+2Fe3+,可判断出离子的还原性从强到弱的顺序是( )。
A.Br-、Fe2+、I- B.I-、Fe2+、Br- C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
解析:反应(1)中还原剂是I-,还原产物是Fe2+,故还原性I->Fe2+;反应(2)中还原剂是Fe2+,还原产物是Br-,故还原性Fe2+>Br-。综合起来可知还原性I->Fe2+>Br-,应选(B)。
三、反应先后的一般规律
在浓度相差不大的溶液中,同时含有几种还原剂时,若加入氧化剂,则它首先与溶液中还原性最强的还原剂作用;同理,同时含有几种氧化剂时,若加入还原剂,则它首先与溶液中氧化性最强的氧化剂作用。
例如1993年全国高考化学题中涉及到NaBr、H2SO4、MnO2之间发生的主要反应的化学方程式。我们知道,浓H2SO4,可氧化Br-,MnO2也可氧化Br-,究竟是发生反应2NaBr+3H2SO4(浓)+MnO2 ![]() 2NaHSO4+MnSO4+2H2O+Br2↑,还是2NaBr+3H2SO4(浓)=2NaHSO4+SO2↑+2H2O+Br2↑?这就要分析浓H2SO4、MnO2的氧化性哪个更强些。我们熟知浓H2SO4不能氧化Cl-而MnO2可氧化Cl-,说明MnO2的氧化性比浓H2SO4强,故前述两个反应中第一个是正确的。
2NaHSO4+MnSO4+2H2O+Br2↑,还是2NaBr+3H2SO4(浓)=2NaHSO4+SO2↑+2H2O+Br2↑?这就要分析浓H2SO4、MnO2的氧化性哪个更强些。我们熟知浓H2SO4不能氧化Cl-而MnO2可氧化Cl-,说明MnO2的氧化性比浓H2SO4强,故前述两个反应中第一个是正确的。
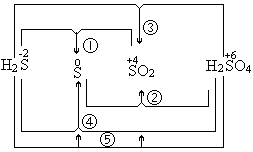
四、价态归中的规律
含同种元素不同价态的物质间发生氧化—还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”的规律。这里的中间价可以相同(谓之“靠拢”),也可以不同——但此时必是高价转变成较高中间价,低价转变成较低中间价(谓之“不相错”)。例如不同价态硫之间可以发生的氧化—还原反应是:
五、电子得失的规律
在任何氧化—还原反应中,氧化剂得电子(或共用电子对偏向)总数与还原剂失电子(或共用电子对偏离)总数一定相等。
例3(1993年高考题)硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是( )。
A.1∶3 B.2∶3
C.1∶1 D.4∶3
![]()
设有n摩电子得失,则得到氧化产物N2为n/6摩,还原产物SO2为n/2摩,它们的物质的量之比n/6∶n/2=1∶3,故选(A)。

- 全部评论(0)

