“十字交叉法”计算式的差值比
时间:2016-01-09 20:11 来源: 作者:张澳 点击:次 所属专题: 十字交叉法
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
凡涉及两个组分量,具有一个平均值的题型可采用“十字交叉法”求解。但在求解过程中,把所得差值量比的含义搞错的屡见不鲜。笔者拟定以下几个题型举例分析说明之。
“十字交叉法”的含义可这样理解:
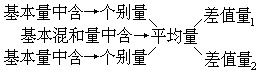
上述所得差值量的单位应与基本量的单位相同,但两差量的比不一定是原基本量(如浓度、体积等)的比。
1.求质量比的计算
【例1】1体积98%的浓硫酸(密度为1.84g/cm3)与4体积水(密度为1g/cm3)混和,求所得硫酸的百分比浓度。
分析:该题属于两个组分量(98%和0%)求平均值(设为a%)的计算,可采用“十字交叉法”计算。平均值的含义为“100g混和溶液中含ag硫酸”。所以所得差值之比为溶液质量之比。
【解】设混和后溶液百分比浓度的a%
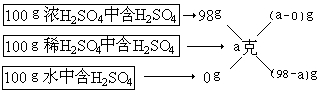
基本量是溶液的质量,差值之比是浓H2SO4和水的质量之比。
即:a:(98-a)=(1×1.84)∶(4×1)
解得a=30.9
答:所得H2SO4的百分比浓度为30.9%
2.求溶液体积比的计算
【例】5mL浓度为1mol/L的烧碱溶液,可稀释成0.05mol/L的烧碱溶液多少毫升?
分析:本题属于两个组分量(1mol/L和0mol/L)求平均值(0.05mol/L)的计算,可用“十字交叉法”计算。平均值含义为“1L稀溶液含NaOH0.05mol”。所以求出的差量之比为溶液的体积比。
【解】
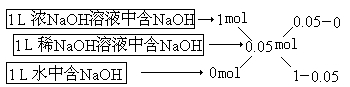
这里差值之比0.05∶(1-0.05)=1∶19显然是浓NaOH溶液和水的体积之比。
设混和后0.05mol/L溶液体积为VmL,有:
1∶(1+19)=5∶V V=5×20=100
答:可稀释成0.05mol/L的烧碱溶液100mL。
3.求物质的量之比(或气体体积比)的计算
【例】相同状况下,11.2L乙烷和丁烷的混合气体完全燃烧,需要47.6L氧气,则混合气体中乙烷和丁烷的物质的量之比为多少?
分析:本题平均量含义为:11.2L混合气完全燃烧需47.6L氧气”。所以求出的差量之比为气体的体积之比或物质的量之比。
【解】由乙烷、丁烷分别完全燃烧的化学方程式可得:
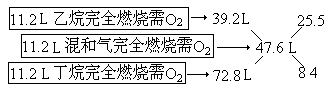
答:混合气体中乙烷和丁烷的物质的量之比为3∶1。
以上例题,重点掌握平均值的含义,从此含义中就可以知道差值比的含义了。

- 全部评论(0)
评论 “十字交叉法”计算式的差:很好的资料!
