分子立体结构的判断方法详解
时间:2022-07-29 10:20 来源:未知 作者:邵磊 点击: 次 所属专题: 分子空间结构判断
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、价层电子对互斥模型(VSEPR models)
把分子分成两大类:一类是中心原子上的价电子都用于形成共价键。如CO2、CH2O、CH4等分子中的C原子。它们的立体结构可用中心原子周围的原子数来预测,概括如下:

另一类是中心原子上有孤对电子(未用于形成共价键的电子对)的分子。如H2O和NH3中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。因而H2O分子呈V形,NH3分子呈三角锥形。
注意:
1、理论模型:分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向于尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
2、运用价层电子对互斥模型可预测分子或离子的空间构型,但要注意判断其价层电子对数,对ABn型分子或离子,其价层电子对数的判断方法为:
![]()
3、在确定中心原子的价层电子对数时应注意如下规定:
①作为配体原子,卤素原子和氢原子提供一个电子,氧族元素的原子不提供电子;
②作为中心原子,卤素原子按提供7个电子计算,氧族元素的原子按提供6个电子计算;
③对于复杂离子,在计算价层电子对数时,还应加上负离子的电荷数或减去正离子的电荷数;
④计算电子对数时,若剩余1个电子,也当作1对电子处理,双键、叁键等多重键作为1对电子看待。
4、价电子之间的斥力:
①电子对之间的夹角越小,排斥力越大;
②由于成键电子对受两个原子核的吸引,所以电子云比较紧缩,而孤对电子只受到中心原子的吸引,电子云比较“肥大”,对邻近电子对的斥力较大,所以电子对之间的斥力大小顺序如下:孤电子对-孤电子对>孤电子对-成键电子>成键电子-成键电子
③由于三键、双键比单键包含的电子数多,所以其斥力大小顺序为:三键>双键>单键。
5、价层电子对互斥模型说明的是价层电子对形成的σ键的共用电子对和孤对电子对的空间构型,而分子的空间构型指的是形成σ键电子对的空间构型,不包括孤对电子。它包括两种类型:
①当中心原子无孤对电子时,两者的构型一致;
②当中心原子有孤对电子时,两者的构型不一致。如:
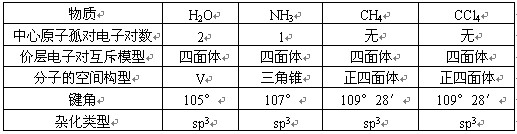
二、杂化轨道理论:
杂化的概念:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫杂化轨道。一般情况下,我们所考虑的杂化是指s和p轨道之间的杂化。
根据参与杂化的s轨道与p轨道的数目,存在sp3、sp2、sp三种杂化,sp3 杂化轨道表示由一个s轨道与叁个p轨道杂化形成的,sp2 杂化轨道表示由一个s轨道与两个p轨道杂化形成的,sp杂化轨道表示由一个s轨道与一个p轨道杂化形成的。
注意:
1、对于非过渡元素,由于ns和np能级接近,往往采取sp型杂化
2、杂化轨道成键时,要满足化学键间最小排斥原则,键与键间排斥力的大小既决定于键的方向,又决定于杂化轨道间的夹角。由于键角越大化学键之间的排斥力越小。杂化轨道间的夹角与分子内的键角不一定相等,中心原子杂化类型相同时孤对电子对越多,键角越小,无孤对电子时,键角相同。三种杂化轨道的轨道形状,sp杂化夹角为180°的直线形杂化轨道,sp2 杂化轨道为120°的平面三角形,sp3杂化轨道为109°28′的正四面体构型;
3、杂化轨道与参与杂化的原子轨道数相同,但能量不同;
4、杂化轨道应尽量占据整个空间使它们之间的排斥力最小;
5、杂化轨道的类型与分子的空间构型有关
6、杂化类型的判断:
①公式:
![]()
或:n=中心原子的孤对电子对数+配位原子总数
②根据n值判断杂化类型:
n=2时,sp杂化;n=3时,sp2杂化;n=4时,sp3杂化;
③当电荷数为正值时,公式中取“-”,当电荷数为负值时,公式中取“+”;当配位原子为氧原子或硫原子时,成键电子数为0。
④杂化轨道所形成的化学键一般为单键,即为σ键。
7、用短线表示共用电子对,和小黑点表示孤对电子的式子称为路易斯电子式,它既标出了成键电子对数,又标出了孤对电子对数,更有利于对物质空间结构的判断。

- 全部评论(0)
