怎样讲述键的极性
时间:2012-12-03 11:33 来源: 作者:张修鹏 点击: 次 所属专题: 键的极性
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在现行高中化学课本中,有关极性键和非极性键的概念是这样阐述的:“在单质分子中,同种原子形成的共价键,两个原子吸引电子的能力相同,共用电子对不偏向任何一个原子,这两个电子在键的中央出现的机会最多,成键的原子都不显电性。这样的共价键叫做非极性共价键,简称非极性键。”
“在化合物的分子中,不同种原子形成的共价键,由于不同原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力强的原子一方,也就是说,靠近吸引电子能力强的原子一方电子云比较密集。因而吸引电子能力强的原子就带部分负电荷,吸引电子能力较弱的原子就带部分正电荷,这样的共价键叫极性共价键,简称极性键”。
笔者认为以上两段论述中有几处是不严密的,因而容易使学生产生误解。第一,容易给学生造成一种只有单质分子中才存在非极性共价键的认识。实际上,在某些化合物分子中的同种原子之间也存在非极性共价键。例如乙烷分子中的C—C键就是非极性键。第二,因为单质是同种元素的原子结合成的分子,按书中说法,好象单质分子中的键都应是非极性键。事实上也有例外,例如O3分子中的O—O键就是极性的,因而也就造成O3分子是极性分子,其偶极矩为0.53D。第三,依第二段的叙述,好象不同种原子形成共价键时,由于两种原子吸引电子能力差别,吸引电子能力强的一方就必然带部分负电荷,吸引电子能力弱的一方就必然带部分正电荷,实际上,这种情况也有例外。例如CO分子,两种原子中,O的吸引电子能力显然比碳强,应是O的一端带部分负电荷,碳的一端带部分正电荷。但实验证明CO的偶极为C-O+,正好与上面的判断相反。
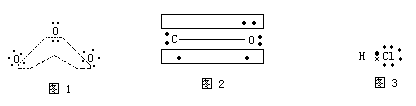
关于分子中两原子之间形成的共价键,其极性的有无以及偶极取向如何?不但和两原子吸引电子能力相对大小有关,而且还和成键方式有关。例如O3分子的结构如图1,分子中不但存在着电子对σ键,还存在一个П43大П键。大П键是由sp2杂化的中心氧原子上未杂化的两电子占据的p轨道和两个端O的单电子占据的p轨道侧面重迭而形成的。可见,中心氧原子在形成大П键时多拿出一个电子,由于П电子的电子云是趋向平均化的。平均化后就相当于中心氧原子失去部分负电荷端氧得到部分负电荷。所以O3中的O—O键是极性的。再如,CO分子,其结构如图2,有三个电子对键。从原子吸引电子的能力看,CO的偶极应为C+O-;但从三键结构看,其中一个电子对键的两个电子是氧原子单独拿出的,这种键为配键,此电子对的共享就意味着氧原子失去部分负电荷,碳原子得到部分负电荷,所以CO的偶极为C-O+。以上两种判断正好相反,但这里后者是主要的,正确的CO的偶极应为C-O+。
当然,教学内容应该注意到学生的基础和知识的阶段性。但作为一门科学的论述应该具有严密性,二者并不矛盾。论述的严密性一方面不致于使学生产生误解,另一方面也有利于培养学生严密的科学态度。为此,笔者建议把书中论述修改如下。
“在单质或化合物分子中,两个原子形成的共价键,若共用电子对不偏向任何一个原子,这样的共价键叫非极性共价键,简称非极性键;否则,就叫极性共价键,简称极性键”。
一般,在单质分子中,由于成键原子吸引电子的能力相同,共用电子对不偏向任何一个原子,所成的键就是非极性键。例如,Cl—Cl键和H—H键就是非极性键。在化合物分子中,不同原子形成的共价键,由于不同原子吸引电子的能力不同,共用电子对必偏向吸引电子能力强的原子,这样的键就是极性键,并且,一般说来,吸引电子能力强的原子就带部分负电荷,吸引电子能力弱的原子带部分正电荷。例如,在HCl分子中,Cl原子吸引电子的能力比H原子强,成键的电子云偏向Cl原子一端,使Cl原子带部分负电荷,H原子带部分正电荷。因此,HCl分子可以用图3的电子式来表示。
在以上修改的论述中,把极性键和非极性键的定义和举例分成两段,就使得定义严密,举例也不失实。在举例一段中,有两处出现“一般”,意味着在这两处还有特殊情况,至于特殊情况是什么以及特殊情况出现的原因,考虑到学生的基础,可以不给学生详细提及,教师要做到心中有数。

- 全部评论(0)
