不同类型的沉淀,一定无法比较Ksp的大小关系?
时间:2025-04-23 08:21 来源:未知 作者:化学自习室 点击:次 所属专题: 沉淀转化
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
【学生疑问】教材上有两个实验,一个是AgI转化为Ag2S,一个是Mg(OH)2转化为Fe(OH)3,这两个实验能不能说明沉淀的Ksp大小关系呢?


因为沉淀类型不同,所以还是无法比较二者的Ksp吗?
【释疑】首先,我们一起来回顾一下教材是如何说明Ksp(AgCl)大于Ksp(AgI)的:

【分析一】
实验【3-4】AgI转化为Ag2S,能不能说明Ksp AgI>Ksp Ag2S?
答:可以。
解析:

(注:严谨一点,应该确切地算一下剩下的碘离子有多少)
反思:如果加入的硫化钠的浓度大于1mol/L,又还能不能比较二者的Ksp呢?
仍然产生沉淀,则加入瞬间的Q仍然>Ksp(Ag2S)。假设加入1mL 6mol/L 硫化钠,加入瞬间,硫离子浓度被稀释为2mol/L。此时的Q=2×Ksp(AgI)>Ksp(Ag2S),这样来看,得到的结论反而是:Ksp(AgI)<Ksp(Ag2S),所以在命制和解答该类型题目时,我想还应该重点关注一下加入试剂的浓度和用量。
【分析二】
实验【3-5】Mg(OH)2转化为Fe(OH)3,又能不能说明Ksp Mg(OH)2>Ksp Fe(OH)3?
答:可以。
解析:

反思:如果加入4滴 NaOH的浓度为0.2mol/L,又还能不能比较二者的Ksp呢?例如,下面这道题:

解析:

注:今天上课评讲这道题的时候,学生提出可以不用进行如此复杂的计算,仍然可以解决二者大小关系判断。推荐!!!(不由感慨学生和数学的强大~)
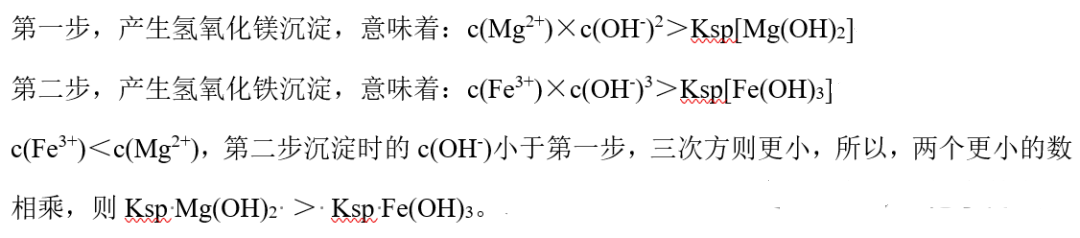
【分析三】
Ag2CrO4转化为AgCl,能不能说明Ksp Ag2CrO4>Ksp AgCl?
答:不可以。
解析:

【结论】总结起来看,一个沉淀转化为另一个沉淀,能否比较其Ksp的大小,不能一概而论,最本质的方法应该是利用Q与Ksp的关系进行定量分析(不管详细计算,还是数学中的放大方法进行分析)。所以,命题时需要把握试剂的用量和浓度,避免随意设置浓度导致逆事实规律的情况出现。

- 全部评论(0)
