谈谈盐类水解离子方程式的书写与应用
时间:2019-06-28 18:38 来源:未知 作者:栾春武 点击: 次 所属专题: 盐类水解应用 盐类水解方程式
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、盐类水解方程式的书写一般要注意一下几点:
(1)一般来说盐类水解的程度不大,是中和反应的逆反应,由于中和反应趋于完成,所以盐类的水解反应是微弱的,盐类水解的离子方程式一般不写“===”,而是写“![]() ”。由于盐类的水解程度一般都很小,通常不生成沉淀和气体,因此盐类水解的离子方程式中一般不标“↓”或“↑”的气标,也不把生成物(如NH3·H2O、H2CO3等)写成其分解产物的形式。
”。由于盐类的水解程度一般都很小,通常不生成沉淀和气体,因此盐类水解的离子方程式中一般不标“↓”或“↑”的气标,也不把生成物(如NH3·H2O、H2CO3等)写成其分解产物的形式。
(2)多元弱酸的酸根离子水解是分步进行的,且以第一步水解为主,例如Na2CO3的水解:第一步:CO32-+
H2O![]() HCO3-+
OH-、第二步:HCO-+ H2O
HCO3-+
OH-、第二步:HCO-+ H2O![]() H2CO3+
OH-。多元弱碱的阳离子水解复杂,可看做一步水解,例如Fe3+
的水解:Fe3+ + 3H2O
H2CO3+
OH-。多元弱碱的阳离子水解复杂,可看做一步水解,例如Fe3+
的水解:Fe3+ + 3H2O![]() Fe(OH)3+
3H+。
Fe(OH)3+
3H+。
(3)多元弱酸的酸式酸根离子既有水解倾向又有电离倾向,以水解为主的,溶液显碱性;以电离为主的溶液显酸性。例如:HCO3-、HPO42-在溶液中以水解为主,其溶液显碱性;HSO3-、H2PO4-在溶液中以电离为主,其溶液显酸性。
(4)能发生双水解的离子组,一般来说水解都比较彻底,由于不形成水解平衡,书写时生成物出现的沉淀、气体物质要标明状态,即标上“↓”、“↑”符号,中间用“===”连接,如NaHCO3溶液与Al2(SO4)3溶液混合:Al3+ + 3HCO3-=== Al(OH)3↓+ 3CO2↑,和此类似的还有:Al3+ 与CO32-、HCO3-、S2-、HS-、SiO32-、AlO2-;Fe3+ 与CO32-、HCO3-、SiO32-、AlO2-;NH4+与SiO32-、AlO2-等。注意一定要利用电荷守恒将其配平,看反应物中是否需要加水。
二、盐类水解的应用
(1)分析盐溶液的酸碱性,并比较酸碱性的强弱,如相同浓度的Na2CO3、NaHCO3溶液均显碱性,且碱性Na2CO3>NaHCO3。
(2)配制某些能水解的盐溶液时要防止水解,如配制FeCl3溶液时,要向该溶液中加入适量的盐酸。
(3)将活泼的金属放在强酸弱碱盐的溶液里,会有气体产生,如将镁条放入NH4Cl溶液中会有H2放出。
(4)热的纯碱溶液有较好的去污能力,是因为升高温度促进盐类的水解,使纯碱溶液的碱性增强,加速了油污的水解,故热额纯碱溶液去油污的效果更好。
(5)明矾净水,将明矾溶于水能生成胶状的氢氧化铝,能吸附水里水里悬浮的杂质,并形成沉淀使水澄清。
(6)泡沫灭火器的原理就是利用强酸弱碱盐与强碱弱酸盐的强烈的应用,如饱和的硫酸铝溶液与饱和的碳酸氢钠溶液混合后的离子方程式为:Al3+ + 3HCO3-=== Al(OH)3↓+ 3CO2↑,现象为白色沉淀和大量的气泡产生,由于CO2的存在故可起到灭火作用。
(7)铵态氮肥使用时不宜与草木灰混合使用,因为草木灰中主要含有K2CO3,其水解显碱性,与铵盐中的NH4+反应。
(8)判断溶液中的离子能否大量共存时需要考虑盐类的水解,能发生双水解的离子不能大量共存。
(9)分析某些盐溶液不能用蒸发结晶法获得的原因:
①金属阳离子易水解的挥发性强酸盐溶液蒸干后得到氢氧化物,继续加热后得到金属氧化物,如FeCl3、AlCl3溶液蒸干灼烧得到的是Fe2O3、 Al2O3而不是FeCl3、AlCl3固体。
②金属阳离子易水解的难挥发性强酸盐溶液蒸干后得到原溶质,如Al2(SO4)3等。
③阴离子易水解的强碱盐,如Na2CO3等溶液蒸干后可得到原溶液。
④阴阳离子均易水解,此类盐溶液蒸干后得不到任何物质,如(NH4)2CO3等。
⑤不稳定化合物的水溶液,加热时在溶液中就能分解,也得不到原溶质。如Ca (HCO3)2溶液,蒸干后得到CaCO3。
⑥易被氧化的物质,其溶液蒸干后得不到原溶质,如FeSO4、Na2SO3等,蒸干后得到其氧化产物Fe2(SO4)3、Na2SO4等。
三、高考题赏析
【例题1】(2010四川理综卷10)有关①100 mL
0.1 mol/L NaHCO3、②100mL 0.1 mol/L
Na2CO3两种溶液的叙述不正确的是
A.溶液中水电离出的H+ 个数:②>① B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c(CO32-)>c(H2CO3) D.②溶液中:c(HCO3-)>c(H2CO3)
解析:本题考查盐类水解知识;盐类水解促进水的电离,且Na2CO3的水解程度更大,碱性更强,故水中电离出的H+
个数更多,A项正确;B②钠离子的物质的量浓度为0.2
mol/L而①钠离子的物质的量浓度为0.1
mol/L根据物料守恒及电荷守恒可知溶液中阴离子的物质的量浓度之和:②>①,B项正确;C项NaHCO3水解程度大于电离所以
c(H2CO3)>c(CO32-);D项Na2CO3
中的CO32-分步水解,第一步水解占主要地位且水解大于电离,D项正确。C、D两项写出它们的水解及电离方程式也能判断。Na2CO3的水解:第一步:CO32-+
H2O![]() HCO3-+
OH-、第二步:HCO-+
H2O
HCO3-+
OH-、第二步:HCO-+
H2O![]() H2CO3+ OH-。
H2CO3+ OH-。
答案:C
【例题2】将AlCl3溶液和Na2S溶液混合,能制的Al2S3吗?
答案:不能,这两种盐溶液能发生水解反应时,相互促进,得不到Al2S3。反应的离子方程式如下:2
Al3++ 3S2-+ 6H2O
===2Al(OH)3↓+ 3H2S↑。要想得到Al2S3,必须在干燥的环境下用Al粉和S粉混合,然后加热:2Al
+3S ![]() Al2S3即可。
Al2S3即可。
【例题3】(2010年江苏卷12)常温下,用 0.1000 mol/L
NaOH溶液滴定 20.00 mL0.1000 mol/L CH3COOH溶液所得滴定曲线如右图。下列说法正确的是
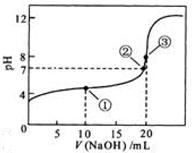
A.点①所示溶液中:c(CH3COO-)
+ c(OH-)
=c(CH3COOH) + c(H+)
B.点②所示溶液中:c(Na+) = c(CH3COOH) + c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
解析:本题主要考查的是粒子浓度大小的比较。A项,处于点①时,酸过量,根据电荷守恒,则有 c(H+) = c(CH3COO-) + c(OH-) B项,在点②时,pH=7。仍没有完全反应,酸过量,c(Na+)<c(CH3COOH) + c(CH3COO-) ;C项。当V(NaOH)=20 mL时,两者完全反应,此时由于CH3COO-的水解,溶液呈碱性,但水解程度是微弱的,c(Na+)>c(CH3COO-)>c(OH-)>c(H+) D项,在滴定过程中,当NaOH的量少时,不能完全中和醋酸,则有c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),综上分析可知,本题选D项。
答案:D
【例题4】(09江苏卷) 下列离子方程式与所述事实相符且正确的是
![]() A.漂白粉溶液在空气中失效: ClO-+ CO2+ H2O ===HClO +
HCO3-
A.漂白粉溶液在空气中失效: ClO-+ CO2+ H2O ===HClO +
HCO3-
B.用浓盐酸与MnO2反应制取少量氯气:
MnO2+ 2H++2Cl-![]() Mn2++
Cl2↑+ 2H2O
Mn2++
Cl2↑+ 2H2O
![]() C.向NaAlO2溶液中通入过量CO2制Al(OH)3:
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:
AlO2- +CO2+2H2O=Al(OH)3↓+ HCO-
![]() D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO- + 2Fe(OH)3===2
FeO42-+3Cl-+
H2O + 4H+![]()
解析:漂白粉失效的化学方程式为Ca(ClO)2+ CO2+ H2O
===CaCO3↓↓+
2HClO,那么该反应的离子方程式是Ca2++ 2ClO-+ CO2+ H2O ===CaCO3↓+
2HClO,A项错;实验室制取Cl2的原理是浓盐酸和二氧化锰反应,离子方程式为
MnO2+ 4H++2Cl-![]() Mn2++
Cl2↑+ 2H2O,所以B项错;D项,在强碱溶液中,不可能生成H+,故D错。
Mn2++
Cl2↑+ 2H2O,所以B项错;D项,在强碱溶液中,不可能生成H+,故D错。
答案:C
【例题5】
![]()
![]() (09全国卷)现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是
(09全国卷)现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是
![]()
![]() A.
④①②⑤⑥③ B. ④①②⑥⑤③
A.
④①②⑤⑥③ B. ④①②⑥⑤③
![]()
![]() C.
①④②⑥③⑤ D. ①④②③⑥⑤
C.
①④②⑥③⑤ D. ①④②③⑥⑤![]()
![]()
解析:①②④均属于酸,其中醋酸最强,碳酸次之,苯酚最弱。③⑤⑥均属于强碱弱酸盐,根据越弱越水解的原理知,因H2CO3>苯酚>HCO3-,所以对应的盐,其碱性为:碳酸钠>苯酚钠>碳酸氢钠,pH顺序相反,故C项正确。
答案:C

- 全部评论(0)
