如何判断氧化性、还原性的强弱?
时间:2014-09-24 09:14 来源:未知 作者:祝其君 点击: 次 所属专题: 还原性 氧化性
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氧化性、还原性的强弱是学生最头疼的,即使到了高三,有的学生也是判断不清而强记氧化性、还原性强弱顺序。即使我们心里清楚,影响氧化性、还原性强弱的因素有温度、浓度等,但是为了考试,还是不得不给出一个顺序。但是这个顺序有多不靠谱呢?有的老师心里也没有底。
 HCl+HClO,可以得出Cl2(aq)的氧化性大于HClO;但是Eθ(Cl2/Cl-)=1.36V、Eθ(HClO/Cl-)=1.49V或Eθ(HClO/Cl2)=1.63V,可见HClO的氧化性大于Cl2(aq)。这是为什么呢?在氯气与水的反应中,由于氯气和次氯酸的标准电极电势相差不大,反应可逆。生成的次氯酸比较少、浓度低,因而实际上溶液中次氯酸的条件电极电势(根据能斯特方程式可以计算)是低于氯气的。这是浓度的缘故,使得氧化性在不同的时候,顺序不同。
HCl+HClO,可以得出Cl2(aq)的氧化性大于HClO;但是Eθ(Cl2/Cl-)=1.36V、Eθ(HClO/Cl-)=1.49V或Eθ(HClO/Cl2)=1.63V,可见HClO的氧化性大于Cl2(aq)。这是为什么呢?在氯气与水的反应中,由于氯气和次氯酸的标准电极电势相差不大,反应可逆。生成的次氯酸比较少、浓度低,因而实际上溶液中次氯酸的条件电极电势(根据能斯特方程式可以计算)是低于氯气的。这是浓度的缘故,使得氧化性在不同的时候,顺序不同。
再比如,有个很经常会遇到,但是可能不少师生却没有注意到的问题——氧气和氯气的氧化性大小?这个强弱顺序的判断,有不少结论和证据,这里不能完全归纳,只列举一、二。
有的人,从氯气通入水中无法氧化水,以适当的电压(稍大于氯离子放电的电压)电解饱和食盐水的时候,出来的是氯气而不是氧气,推出氯气的氧化性小于氧气。这两个反应都是在水溶液中进行的,能用电极电势进行解释(电极电势只适合于解释溶液中的氧化性、还原性强弱)。首先,氯气的标准电极电势大于氧气(但相差不大),但是电极电势是一个热力学参数,无法用于解释动力学上的速率问题。在《无机化学丛书。第六卷》,提到,在某pH下,不管Cl2、Br2、I2在水溶液中都是可以氧化水生成氧气的。只是这个速率非常慢,并伴随卤素的歧化反应,因而很难观察到明显现象。所以这个“无法氧化”只是说明了反应的动力学上的困难,而氧化性则依然是氯气大于氧气。在电解饱和食盐水的时候,是由于氧气在电极上析出,一般都会存在很大的阻碍作用(电化学极化等),也是动力学上的困难。因此,不能据此判断氯气氧化性小于氧气。
所以,在水溶液中,通常是氯气的氧化性大于氧气的(根据电极电势判断)。
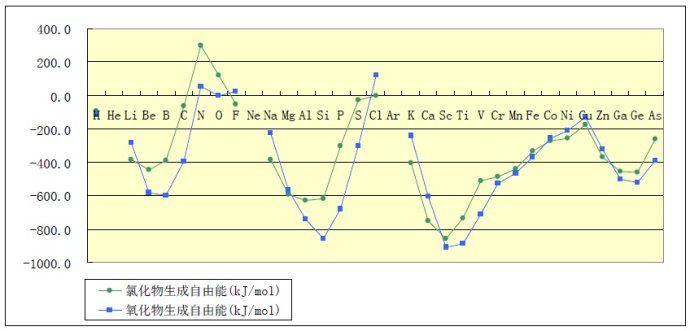
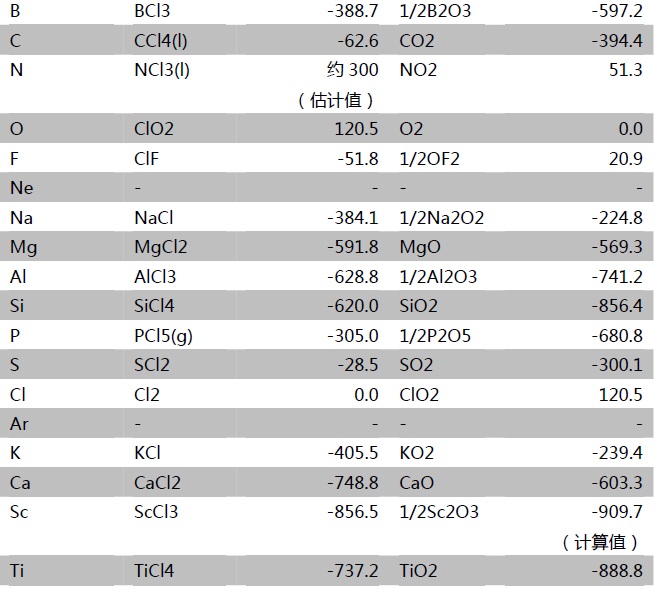
那不在水溶液中呢?此时不能使用电极电势进行判断,可以借助自由能的大小进行判断。生成自由能是单质间反应能力强弱的一个标度,生成自由能越负,化合物的能量越低。若氧化物的生成自由能低于氯化物的,说明常温下氧气可以置换出该氯化物中的氯生成氧化物和氯气。若生成自由能为正,表明常温下该化合物不能通过稳定单质间的化合生成。

- 全部评论(0)
草原(1162506276) 评论 href="/plus/view.php?aid=15150">如何判断氧化性、还:证据推理充分,那么请问歧化反应中怎么比较物质氧化性,还原
