自身氧化还原反应与歧化反应的区别
时间:2015-01-22 15:48 来源:未知 作者:何永成 点击: 次 所属专题: 歧化反应
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
自身氧化还原反应,是指氧化剂和还原剂都是同一物质的氧化还原反应,反应时物质里的不同元素或相同元素间发生了电子转移。歧化反应,它指的是同一物质的分子中同一价态的同一元素间发生的氧化还原反应。同一价态的元素在发生氧化还原反应过程中发生了“化合价变化上的分歧”,有些升高,有些降低。
故氯气与水反应属于歧化反应;
Cl2+H2O=HCl+HClO
但氯酸钾制氧气不属歧化反应
2KClO3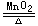 2KCl+3O2
2KCl+3O2
因为这种自身氧化还原反应,电子的转移虽发生在同种物质中不同元素之间,但并不发生在同一物质的同种元素之间。
还有硝酸铵受撞击分解不属歧化反应
2NH4NO3![]() 2N2+O2+4H2O ,条件:高于300摄氏度
2N2+O2+4H2O ,条件:高于300摄氏度
因为这种自身氧化还原反应,电子的转移虽发生在同种物质中同种元素之间,但并不发生在同一价态的同种元素之间;发生歧化反应的元素必须具有相应的高价态和低价态化合物,歧化反应只发生在中间价态的元素上。氟(F2)无歧化作用,因为氟元素电负性最大,无正化合价,只有负化合价。
综上所述可知:自身氧化还原反应与歧化反应均属同种物质间发生的氧化还原反应,歧化反应是自身氧化还原反应的一种,但自身氧化还原反应却不一定都是歧化反应。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
